Гдз химии практическая работа 1. Исправьте ошибки и расставьте коэффициенты
В данном приложении собраны инструктивные карты практических работ по химии для учащихся 8-х классов.
«Практическая работа №1 - 8 кл»
| Практическая работа №1 Приемы обращения с лабораторным оборудованием и нагревательными приборами
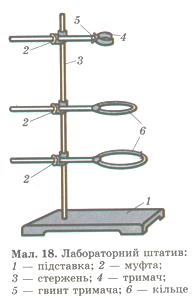
Цель работы: Познакомиться с устройством и основными приемами обращения с лабораторным оборудованием. Оборудование: Ход работы 1. Устройство штатива (нарисовать штатив, обозначить его составные части) 2.Устройство спиртовки (нарисовать спиртовку, обозначить её составные части) 3.Посуда (нарисовать пробирки, колбы, химический стакан) 4.Фильтрование приготовить фильтровальную бумагу; смочить фильтровальную бумагу; вложить в воронку; жидкость наливают, по стеклянной палочке, направляя её на стенку воронки; фильтрат, стекает по стенке стакана, а не в центр, чтобы не выплёскивался. Найти в тексте определения фильтрата, осадка и процесса фильтрования. |
Просмотр содержимого документа
«Практическая работа №2 - 8 кл»
| Практическая работа № 2 Цель работы Оборудование Ход работы
|
| Практическая работа №2 Очистка загрязненной поваренной соли Инструктаж по технике безопасности Цель работы : Научиться проводить разделение смесей, очистку веществ, фильтрование. Оборудование : смесь песка с солью, 2 стаканчика, стеклянная палочка, промывалка с водой, фильтр, воронка, спички, спиртовка, зажим, чашка для выпаривания. Ход работы
Фронтальное обсуждение последовательности действий при разделении смеси песка и соли. Оформление таблицы и её заполнение по ходу работы.
|
Просмотр содержимого документа
«Практическая работа №3- 8 кл»
| Практическая работа №3 Наблюдение за изменениями, происходящими с горящей свечой, и их описание Инструктаж по технике безопасности Цель работы : Изучение строения пламени. Определение продуктов горения. Оборудование Реактивы : Известковая вода. Ход работы Опыт 1. Физические явления при горении: Зажгли свечу. Наблюдали: таяние парафина. Вывод: Это физический процесс – плавление. Опыт 2. Наблюдали : на предметном стекле, внесённом в зону темного конуса пламени, образовалось чёрное пятно – сажа. Вывод: Опыт 3. Наблюдали : сухая пробирка, находящаяся над пламенем запотела. Вывод: Опыт 4. Наблюдали : в эту же пробирку быстро прилили известковой воды, она помутнела. Вывод: Опыт 5. Наблюдали : усиление яркости пламени при продувании грушей около пламени. Вывод: Опыт 5. Наблюдали : горение свечи дольше под большим химическим стаканом, чем под маленьким. Вывод: Заполните таблицу:
|
Просмотр содержимого документа
«Практическая работа №7 - 8 кл»
| Практическая работа №7 Свойства кислот, оснований, оксидов и солей Инструктаж по технике безопасности. Цель работы : осуществить реакции, характеризующие некоторые свойства кислот, оснований, оксидов и солей. Оборудование : штатив с пробирками. Реактивы Ход работы Задание 1. Осуществите реакции, характеризующие свойства растворов: Соляной кислоты(1 вариант), серной кислоты(2 вариант)
Задание 2 . Проделайте реакции, характеризующие свойства раствора гидроксида натрия(1 вариант) Получите гидроксид железа(III ) реакцией обмена и осуществите реакции, характеризующие его химические свойства(2 вариант)
Задание : Осуществить реакции; Определить тип реакции, обратимость; Для реакций ионного обмена привести уравнения в молекулярном, в полном и сокращенном ионном виде. Выводы: |
Просмотр содержимого документа
«Практическая работа №8- 8 кл»
| Практическая работа № 8 Решение экспериментальных задач Инструктаж по технике безопасности. Цель работы : Научиться опытным путем получать или определять вещества. Оборудование Реактивы : KCl , MgSO 4 , Zn , PbNO 3 , BaCl 2 , H 2 SO 4 Ход работы
Выводы: Задание: Обнаружение сульфат-ионов SO 4 2- и хлорид-ионов Cl - (стр.238 опыт 3); Получить хлорид цинка ZnSO 4 (стр.242 задание 1): определить тип реакции, обратимость; для реакций ионного обмена привести уравнения в молекулярном, в полном и сокращенном ионном виде. окислительно-восстановительные реакции уравнять методом электронного баланса. |
Просмотр содержимого документа
«Практическая работа №2-8 класс»
Практическая работа №2
Анализ почвы и воды
Цель: определить состав почвы, научиться фильтровать и выпаривать жидкость.
Оборудование:
Инструкция по технике безопасности:
Если зажечь спиртовку сразу же после снятия колпачка, загорается плёнка спирта на горлышке спиртовки как раз на том месте, где колпачок прилегает к горлышку. Пламя проникает под диск с трубкой, и пары спирта внутри резервуара загораются. Может произойти взрыв и выброс диска вместе с фитилём. Чтобы избежать этого, приподнимите на несколько секунд диск с фитилём для удаления паров. Если случится воспламенение паров, быстро отставьте в сторону предметы (тетрадь для практических работ) и позовите учителя.
Зажжённую спиртовку нельзя переносить с места на место, нельзя также зажигать одну спиртовку непосредственно от другой. Для зажигания спиртовки пользуйтесь спичками.
Гасить спиртовку можно только одним способом – накрыть пламя фитиля колпачком. Колпачок должен находиться всегда под рукой.
Предметное стекло закрепляется в держателе у одного из его краёв аккуратно. При этом учитывается, что стекло – хрупкий материал и может треснуть, если на него сильно надавить.
В процессе выпаривания воды из почвенной вытяжки вначале прогревается всё предметное стекло, а затем капля жидкости на нём.
Опыт №1. Механический анализ почвы.
В пробирку помещена почва. Прилейте к ней воду, объём которой должен быть в 3 раза больше объёма почвы. Закройте пробирку пробкой и тщательно встряхивайте 1 – 2 минуты. Наблюдайте за осадком частиц почвы и структурой осадков. Опишите и объясните свои наблюдения.
Опыт №2. Получение почвенного раствора и опыты с ним.
Приготовьте бумажный фильтр, вставьте его в чистую пробирку и профильтруйте полученную в первом опыте смесь почвы и воды. Перед фильтрованием смесь не следует встряхивать. Почва останется на фильтре, а собранный в пробирке фильтрат представляет собой почвенную вытяжку (почвенный раствор).
Несколько капель этого раствора с помощью стеклянной палочки поместите на предметное стекло и подержите его над пламенем спиртовки до выпаривания воды. Что наблюдаете? Объясните.
Возьмите универсальную индикаторную бумагу, нанесите на неё стеклянной палочкой почвенный раствор. Сделайте вывод по результатам своих наблюдений.
Заполните таблицу:
| Что делали | Что наблюдали | ||
Просмотр содержимого документа
«Практическая работа №4 - 8 кл»
| Практическая работа №4. Приготовление растворов Инструктаж по технике безопасности. Цель работы Оборудование Реактивы : Сахар, вода. Ход работы Дано : Н 2 О, С 12 Н 22 О 12 m сахара = ? г. V воды = ? мл. ω сахара =? N сах. = ? |
| Практическая работа №4. Приготовление растворов Инструктаж по технике безопасности. Цель работы : Научиться готовить растворы и определять их массовые доли. Оборудование : Мерный цилиндр, коническая колба, лабораторные весы. Реактивы : Сахар, вода. Ход работы Определить массу сахара (взвесить); Дано : Н 2 О, С 12 Н 22 О 12 m сахара = ? г. V воды = ? мл. ω сахара =? N сах. = ? |
Просмотр содержимого документа
«Практическая работа №5 - 8 кл»
| Практическая работа №5 Признаки химических реакций Инструктаж по технике безопасности Цель работы : 1)провести химические реакции; 2) по признакам химических реакций доказать их осуществление. Оборудование : спиртовка, штатив с пробирками. Реактивы : медная проволока, H 2 SO 4 , HCl , роданид калия (KSCN ), мел (CaCO 3 ), FeCl 3 , Na 2 СO 3 , СaCl 2 . Ход работы Опыт 1. Прокаливание медной проволоки, получение оксида меди (II ) Cu + O 2 = Тип реакции: Взаимодействие оксида меди(II ) с серной кислотой. CuO + H 2 SO 4 = Наблюдения : Тип реакции: Вывод: Опыт 2. Взаимодействие мела с кислотой CaCO 3 + HCl = Наблюдения : Тип реакции: Вывод: Опыт 3. Взаимодействие хлорида железа (III ) с роданидом калия FeCl 3 + KSCN = Наблюдения : Тип реакции: Вывод: Опыт 4. Взаимодействие карбоната натрия с хлоридом кальция Na 2 CO 3 + CaCl 2 = Наблюдения : Тип реакции: Вывод: Заполните таблицу:
|
Просмотр содержимого документа
«Практическая работа №6 - 8 кл»
Практическая работа №6
«Ионные реакции и условия их протекания»
Цель: выяснить условия протекания химических реакций между растворами электролитов до конца.
Оборудование и реактивы:
Выполнение работы
Инструктаж по технике безопасности (подпись)
Опыт №1. Условие первое – выпадение осадка.
В одну пробирку налили 1 мл раствора сульфата меди (II ) и добавили немного раствора щелочи. Наблюдаем образование ______________
CuSO 4 + NaOH = ? + ?
Во вторую пробирку налили раствор хлорида бария и прилили раствор серной кислоты. Наблюдаем образование ______________
BaCl 2 + H 2 SO 4 = ? + ?
(уравнение написать в молекулярной и ионной формах)
Опыт №2. Условие второе – выделение газа.
В две пробирки налили по 1 мл раствора карбоната натрия и добавили в одну пробирку несколько капель азотной кислоты, а в другую – несколько капель соляной кислоты. В обеих пробирках наблюдаем выделение ___________________________.
Na 2 CO 3 + HNO 3 = ? + ?
Na 2 CO 3 + HCl = ? + ?
Опыт №3. Условие третье – образование воды как побочного продукта.
В две пробирки налили по 1 мл раствора гидроксида натрия и добавили несколько капель фенолфталеина. Раствор приобрел ________________ окраску. В одну пробирку добавили раствор серной кислоты, а в другую – раствор азотной кислоты до исчезновения окраски.
NaOH + H 2 SO 4 = ? + ?
NaOH + HNO 3 = ? + ?
(уравнения написать в молекулярной и ионной формах)
Работу оформить в виде таблицы
| №п/п | Реактивы | Наблюдаемый эффект | Уравнения реакций в молекулярном и ионном виде |
| 1 | |||
| 2 | |||
| 3 |
Вывод: Реакции между растворами электролитов протекают до конца в случае выпадения __________, выделения ___________, образования _____________.
Просмотр содержимого документа
«Практические работы 8 класс оборудование и реактивы»
Практические работы 8 класс
| Название работы | Оборудование и реактивы |
|
| Приемы обращения с лабораторным оборудованием | Оборудование: Штатив, спиртовка, лабораторная посуда. |
|
| Очистка загрязненной поваренной соли | Оборудование : смесь песка с солью, 2 стаканчика, стеклянная палочка, промывалка с водой, фильтр, воронка, спички, спиртовка, зажим, чашка для выпаривания. |
|
| Анализ почвы и воды | Оборудование: две пробирки, воронка, бумажный фильтр, стеклянная палочка, предметное стекло, спиртовка, стеклянный цилиндр с водой, пробка, универсальная индикаторная бумага. |
|
| Наблюдение за горящей свечой | Оборудование : Свеча, резиновая груша, пробирки, предметное стекло, 2 химических стакана разного размера. Реактивы : Известковая вода. |
|
| Приготовление растворов | Оборудование : Мерный цилиндр, коническая колба, лабораторные весы. Реактивы : Сахар, вода. |
|
| Признаки химических реакций | Оборудование : спиртовка, штатив с пробирками. Реактивы : медная проволока, H 2 SO 4 , HCl , роданид калия (KSCN ), мел (CaCO 3), FeCl 3 , Na 2 СO 3 , СaCl 2 . |
|
| Ионные реакции и условия их протекания | Оборудование и реактивы: пробирки, растворы сульфата меди (II ), гидроксида натрия, хлорида бария, карбоната натрия, азотной кислоты, серной и соляной кислот, фенолфталеин. |
|
| Свойства кислот, оснований, оксидов и солей | Оборудование : штатив с пробирками. Реактивы : HCl, NaOH, Na 2 CO 3 , AgNO 3 , BaCl 2 , H 2 SO 4 , FeCl 3, фенолфталеин. |
|
| Решение экспериментальных задач | Оборудование : спиртовка, штатив с пробирками. Реактивы : KCl, MgSO 4 , Zn, PbNO 3 , BaCl 2 , H 2 SO 4 |
Практическая работа №1
«Приемы обращения с лабораторным оборудованием».
Дата: 21 02.2011г, 8 «а» класс.
Образовательная цель : знать названия предметов лабораторного оборудования; освоить приемы обращения с лабораторным оборудованием.
Развивающая цель: мышление через постановку вопросов в ходе работы и ответы на вопросы.
Воспитательная цель : воспитывать коммуникативные отношения при работе в паре согласно инструкции; соблюдать дисциплину при выполнении работы.
Оборудование : лабораторный штатив, спиртовка, посуда: пробирки, колбы, химические стаканы; фильтры, воронки, прибор для получения газов.
Дидактический материал: инструкция для работы в паре; таблица «Правила техники безопасности при работе в химической лаборатории».
|
Этапы |
Цель учителя |
Цель ученика |
Действия ученика |
Форма |
Результат |
|
1.Актуализация |
Включить учащихся в деятельность |
1.Принять цель 2.Познакомится с планом работы |
1.Записывает тему урока. 2.Участвует в обсуждении темы. |
Фронтальная, индивидуальная |
Учащиеся готовы к работе. |
|
2.Практическая работа №1. 10мин. |
Знать названия предметов лабораторного оборудования; освоить приемы обращения с лабораторным оборудованием. |
1.Чертят таблицу в тетради. |
Индивидуальная. |
Таблица в тетради. |
|
|
2.1.Читают правила техники безопасности при работе в химической лаборатории на с.174 в учебнике. 2.2.Сравнивают с правилами в инструкции. 2.3..Задают вопросы. 2.4.Раписываются в журнале по ТБ. |
Парная |
Ознакомлены с правилами по ТБ. |
|||
|
3.1.Изучают устройство лабораторного штативы. 3.2.Выполняют задание, указанное в инструкции. 3.3.Делают схематический рисунок и подписывают части. |
Парная |
В таблице заполнены графы. |
|||
|
2.3.Читают ст. «Использование лабораторного штатива». Выполняют описанные в ней действия. |
Парная |
Собран штатив и закреплена пробирка. |
|||
|
3.1.Читают ст. «Приемы работы со спиртовкой». 3.2.Оформляют таблицу. |
Парная |
В таблице заполнены графы. |
|||
|
4.1.Читают ст. «Посуда». |
Парная |
В таблице заполнены графы. |
|||
|
3.Рефлексия |
Соотнести цель с результатами работы на уроке. |
Определить своё место в уроке и оценить свою деятельность. |
Фронтальная |
Результат соответствует цели урока. |
|
|
4.Итог урока |
Оценить деятельность учащихся |
Самооценка |
Выставляют оценки в карту знаний. |
Фронтальная |
1.Устная оценка деятельности всех учащихся. 2.Практическая работа оформлена в тетрадях. |
Инструкция для учащихся:
1.Прочитай инструкцию по технике безопасности при работе в химической лаборатории на с.174-175.
2.Обсудите вопросы, возникшие после чтения. Сформулируйте их для учителя. Задайте вопросы учителю.
3.Распишитесь в журнале по ТБ.
4.Начертите таблицу в тетради.
5.На с. 175 прочтите текст «Устройство лабораторного штатива».
6.Сделайте схематический рисунок и подпишите части.
7.Используя текст «Использование лабораторного штатива» закрепите в лапке штатива пробирку под углом в 45 градусов и на расстоянии 15см от стола. Ответьте на вопрос: Как правильно расположить винт муфты на стержне штатива? Как правильно закрепить пробирку?
8. Прочтите текст «Приемы работы со спиртовкой». Сделайте рисунок и подпишите части. Ответьте на вопросы: Как спиртовку зажигают? Как спиртовку гасят?
9. Прочтите текст «Посуда». Сделайте рисунок, подпишите название. Ответьте на вопросы: Сколько должно быть жидкости в пробирке при перемешивании? Что запрещается? Когда используют воронку? Как готовят фильтр к фильтрованию? Какой объем жидкости должен быть в чашке для выпаривания? Как готовится прибор для получения газов к работе?
10.Сделайте вывод по итогам работы.
Таблица №1
|
Название этапа работы |
Рисунок и название частей оборудования. |
Приемы работы с лабораторным оборудованием. |
|
|
Приемы работы с лабораторным штативом |
1.Винт, закрепляющий муфту находится справа от стержня штатива, а стержни лапки укреплялись бы так, чтобы их поддерживал не только винт, но и муфта. 2.Пробирку закрепляют ближе к горлышку. 3.Пробирка укреплена правильно, если ее можно повернуть в лапке без больших усилий. |
||
|
Приемы работы со спиртовкой |
1.Нельзя зажигать спиртовку от другой горящей спиртовки. 2.Гасят спиртовку накрывая ее колпачком с боку. |
||
|
Приемы работы с посудой. |
1.Высота столбика жидкости при перемешивании растворов в пробирке не должна превышать 2 см. 3.Фильтр перед употреблением смачивают. 4.В чашку наливают 1/3 объёма для выпаривания. 5.Проверить прибор на герметичность. |
Вывод: освоил приемы работы с лабораторным оборудованием.

Составила Филиппова А.В.

Практические работы
для 7 класса

Советы ХИМИИ-- Яги
(правила Техники Безопасности)
Вот послушай-ка, дружок,
Преподам тебе урок,
Чтобы в этот раз, родимый,
Ног ты унести не смог!
У меня тут целый клад:
Калия пермангонат,
Есть и сера, есть и фосфор,
Есть и калия хлорат.
Компоненты точно взвесь,
Разотри получше смесь.
Если все пойдет как надо-
Разнесет здесь все как есть!
Приготовь гремучий газ,
Спичку поднеси тот час.
Тут реакция цепная-
В раз останешься без глаз!
Лей-ка воду в кислоту,
Сульфатную возьми, не ту!
Коль успеешь, то увидишь-
Брызги лягут за версту!
Что же, свет тебе не мил?
Руки щелочью облил?
Так протри глаза руками,
И про руки ты забыл!
Вот понюхай аш- два- эс-
Он всегда снимает стресс. 
От него противоядье
Не нашел еще прогресс!
Рано утром натощак
Ты отведай аммиак.
До слезы он прошибает,
Если сразу не обмяк!
Хлор понюхай-ка, дружок,
Очень многим он помог!
Да вдыхай его поглубже,
Чтобы выдохнуть не смог!
Много всяческих, рецептов
Есть у химии Яги:
Хошь-останешься без пальцев,
Ну а хочешь-без ноги!
Я скажу, внучек, тебе:
Можно жить и без ТБ,
Хоть и плохо, хоть недолго,
Но зато во вред себе

Дата «___» ___________
Практическая работа № 1
Правила техники безопасности. Приемы обращения с лабораторным оборудованием.
__________
Цель работы:
Изучите правила техники безопасности при работе в химическом кабинете
Познакомиться с разными видами химической посуды и возможностями ее использования в химической лаборатории, изучить устройство лабораторного штатива и отработать навыки работы с ним;
Оборудование:
абор химической посуды: пробирки, колбы (коническая, плоскодонная), химические стаканы, мерные цилиндры, фарфоровые чашечки, держатели для пробирок, штатив для пробирок, ложечки и т.д.), лабораторный штатив
ИНСТРУКЦИЯ.
Порядок выполнения работы.
Рассмотрите выданные образцы химической посуды. Определите назначение.
Сделайте рисунки трех предметов химической посуды и объясните, каково их назначение.
Рассмотрите составные части лабораторного штатива, уясните их назначение.
Соберите штатив и закрепите на нем лапку, кольцо.
Зарисуйте собранный штатив, укажите его основные детали.
Зарисуйте части горения пламени, укажите какая часть самая гарячая.
Письменно ответьте на вопросы:
Каковы правила набора твердого вещества из склянки в пробирку?
Как правильно необходимо проводить перемешивание растворов в пробирке?
8. Сделайте вывод по итогам работы.
Ход работы
Задание 1. Образцы химической посуды . (Зарисовать и написать назначение.)
Плоскодонные колбы.
Круглодонные колбы.
Химические стаканы.
Фарфоровые чашечки.
Мерные цилиндры.

Задание 2. Изучить и зарисовать лабораторный штатив

1) стержень;
1 ) поставка;
2 ) муфта;
4) лапка;
5) кольцо.
Задание 3. Ответы на вопросы.
1. Твердые вещества из баночек необходимо брать только сухой ложечкой или сухой пробиркой ?
2. Перемешивание растворов в пробиркепроизводят быстрыми и энергичными движениями. Запрещено
ли
встряхивать пробирку, закрывая отверстие пальцем
?
Задание 4. Строение пламени
1.
2.
3.
4.
Вывод:
Приведите рабочее место в порядок.
Дата «____»_____________г.
Практическая работа № 2
Исследование физических и химических явлений
Цель: изучить физические и химические свойства предложенных веществ, используя различные методы.
Ход работы
Рассмотрите выданные вам образцы различных веществ.
Исследуйте растворимость твердых веществ. Найдите в справочной таблице данные о плотности, температуре кипения, плавления. Результаты проведенного исследования внесите в таблицу.
2. Исследуйте химические свойства цинка .
Взаимодействие с водой
Взаимодействие с соляной кислотой HCl
Взаимодействие с хлоридом меди CuCl 2
Випад е н ие осад ка в результат е х и м и ч еск о й реакц ии
Прилейте в пробирку натрий сульфит и барий хлорид. Наблюдения внесите в таблицу.
В ы д и лен ие газо образных веществ в результат е х и м и ч еских реакц и й .
Гашение соды .
Небольшое количество соды поместите в проби рку и прилейте каплями раствор укссусной кислоты .
Как надо вести себя с кислотой ?
Чт о нужно сделать , если кислота попала на руки?
Наблюдения внесите в таблицу.
Исследование фи зич еских процес со в во время растворения
Нале йте в проби рку 1 мл воды ,додайте шпателем приблизитель но 1 г соли и ра зме шайте стеклянной пало чкой . Що спостерігаєте? Подогрейте. Наблюдения запишите в таблицу.
Результаты проведенного исследования внесите в таблицу:
Вывод: С помощью, каких методов вы изучали вещества во время практической работы?
Как определить газ по запаху?
А) наклониться над сосудом и вдохнуть
Б) направить пары газа к себе и сделать осторожный вдох
В) не знаю

А) при наклоне этикетка оказалась сверху, в ладони
Б) этикетка находится снизу
В) не имеет значения, как взять склянку для реактивов.
При разливе жидкости на столе необходимо:
А) сообщить учителю или лаборанту
Б) самостоятельно убрать разлитое вещество
В) сделать вид, что ничего не случилось.
Почему нельзя собирать на рабочем месте много реактивов?
А) можно перепутать реактивы
Б) создается беспорядок
В) можно запачкать лабораторную тетрадь
Г) все выше перечисленное
Почему нельзя пробирку с раствором нагревать в одном месте:
А) долго не закипит
Б) может произойти выброс жидкости и как следствие ожог руки
В) плохо нагревается
Г) не знаю
Справочная таблица
Дата «____»_____________г.
Практическая работа №2
Исследования физических и химических явлений
Цель: ознакомиться с характерными признаками физических и химических явлений, научиться их выявлять; наблюдать физические и химические явления, описывать наблюдения, делать выводы.
Оборудование: пробирки, сухое горючее, металлический штатив, стеклянная палочка, газоотводная трубка.
Реактивы: медный купорос, железная кнопка, скрепка, гвоздь, пищевая сода, раствор извести.
Ход работы
| Схема реакции: железо + медный купорос = медь + ферум (11) сульфат |
||||
| Схема реакции: |
||||
| Схема реакции: |
||||
| Нагрейте воду до температуры 100 градусов | ||||

Вывод:
Физическое явление-это ____________________________________
Химическое явление-это ____________________________________
Дата «____»_____________г.
Практична робота № 3
Добування кисню в лабораторії та вивчення його властивостей
Мета : ознайомитися із лабораторним способом добування кисню шляхом розкладання калій перманганату, навчитися користуватися приладом для добування кисню, навчитися збирати кисень методом витіснення повітря та витіснення води, вивчити фізичні та хімічні властивості кисню.
Обладнання : лабораторний штатив, пробірка з газовідвідною трубкою, хімічна склянка, циліндр, скляні пластинки, конічна колба, ложечка для спалювання речовин, тигельні щипці, кристалізатор з водою, вата, скіпка.
Реактиви: кристалічний калій перманганат, вапняна вода, вуглинка, сірка, перекис водню.

Хід роботи
Завдання вчителя:
Кислород получают из (назвать 3 вещества)_________________
Собирают кислород (указать метод)________________________
Распознают кислород ____________________________________
Чи можна тримати догори дном посуду, в яку збирають кисень? Відповідь обґрунтуйте.
Чи буває рідкий кисень? Відповідь поясніть.
Яка відносна молекулярна вага Озону і Кисню?
Загальний висновок:
Для кислорода характерны следующие свойства
Задание учителя (на дополнительных 11 баллов)
20г. Сульфур (VI )оксида содержит 12г. Сульфура и 8г. Оксигена. Какие массовые доли элементов в соединении?


Практические работы
для 8 класса

Правила техники безопасности
Чтобы не подвергать свою жизнь опасности,
Надо знать технику безопасности:
Делаешь только то, что положено,
И при этом очень осторожно.
Сначала задачу реши теоретически,
Затем выполняй ее практически.
В химической лаборатории нельзя никогда
Голыми руками брать вещества.
Насыпаешь (наливаешь) вещества аккуратно,
Не высыпаешь (не выливаешь) вещества обратно.
С химическими веществами будь скупым -
Их количеством пользуйся небольшим.
Опыты делаешь тщательно
Над столом (лотком) обязательно.
Нельзя вдыхать пары и газы,
Если ты без противогаза.
Вещества в лаборатории на вкус не изучаются –
Это строго-настрого запрещается.
Нельзя смешивать или сливать
Все химические вещества подряд.
С едкими веществами (кислоты, щелочи) работать можно,
Но крайне осторожно.
Если кислоты или щелочи на тебя попадают,
Их большим количеством воды немедленно смывают.
Кислоту в воду добавляют –
Только так кислоту разбавляют.
Если жидкость воспламеняется легко,
Работаешь с ней от огня далеко.
С приборами нагревательными
Работай очень внимательно.
На рабочем месте – порядок и чистота,
Правило это выполняешь всегда.
Дата «____»_____________г.
Практическая работа № 1
Исследование свойств основных классов неорганических соединений

Цель: выполнить некоторые реакции характерные для кислот, оснований, оксидов и солей, исследовать некоторые качественные реакции на неорганические соединения.
Оборудование: сухое горючее, пробирки, штатив, пробиркодержатель.
Реактивы: индикаторы, хлоридная кислота, натрий гидроксид, натрий сульфит, барий хлорид, натрий карбонат, железная и медная проволока, купрум (2) оксид – порошок.
Ход работы
Общий в ывод:
К акие свойства веществ изучили? К акие признаки реакции наблюдали? Реакции каких типов вы осуществляли, выполняя практическую работу?
Произойдет ли реакция в опыте 2, если вместо цинка взять: а) магний, б) серебро? Ответ аргументируйте.
Произойдет ли реакция в опыте 5, если соль заменить: а) кальций карбонатом; б) натрий нитратом? Ответ аргументируйте.
В неподписанных пробирках содержится раствор натрий хлорида и разбавленная хлоридная кислота. Предложите не менее двух способов распознания этих жидкостей.
Если налил в пробирку избыток растворов реактивов надо:
А) слить обратно
Б) слить в канализацию
В) поставить в известность учителя или лаборанта
Твердые вещества
А) берут руками
Б) берут шпателем
В) берут ложечкой
Г) берут всем выше перечисленным
При попадании на кожу раствора кислоты надо:
А) смыть холодной водой
Б) смыть холодной водой, обработать 2 % раствором соды
Кислоту разбавляют:
А) наливая воду в кислоту
Б) наливая кислоту в воду
В) порядок смешивания не имеет значения
Г) не знаю
Признак реакции:
А) изменение объема жидкости
Б) выпадение осадка
В) изменение формы вещества
Нагревая пробирку её необходимо держать так, чтобы отверстие было направлено
Б) в сторону от себя
Г) в сторону от себя и от соседей

Дата «____»_____________г.
Практическая работа № 2
С техникой безопасности знаком (а) _________________
Ход работы
В двух склянках без этикеток находятся растворы: в одной – соляная кислота, во второй – гидроксид натрия. Как опытным путем доказать, в какой склянке находится каждое из веществ?
Химическим способом отмойте пробирку, загрязненную на практическом занятии гидроксидом железа (III )
Докажите, что выданное вещество – хлоридная кислота.
Из имеющихся на столе реактивов получите несколькими способами сульфат меди (II )
(решите несколько задач по указанию учителя)
Результаты эксперимента оформите в произвольной формы, отметьте наблюдения, запишите уравнения реакций.
Тест по правилам техники безопасности

А) это эстетично
Г) не имеет значения
Почему избыток вещества (реактива) нельзя сливать (ссыпать) обратно в склянку?
А) можно перепутать вещества
Б) загрязнить вещество
В) запачкать руки
Г) трудно открыть пробки
А) не разрешается
Б) можно с согласия учителя
А) смыть холодной водой
В) обработать 2 % раствором уксусной кислоты
А) на отдельном листочке
В) в рабочей тетради

А) на середине пробирки
Б) у отверстия пробирки
В) в нижней части пробирки
Г) не имеет значения
Вывод:
Дата «____»_____________г.
Практическая работа № 2
«Решение экспериментальных задач по теме «Основные классы неорганических соединений»
Цель: повторить свойства оксидов, кислот, оснований и солей и применить эти знания при экспериментальном решении задач; научиться распознавать вещества, помещенные в склянках без этикеток.
С техникой безопасности знаком (а) _________________
Ход работы
Задание №1. Реши «Цепочку превращения», записав при этом правильно формулы веществ, учитывая валентность химических элементов и кислотных остатков..
MgO Mg Cl _ Mg C O _ Mg Cl _ Mg _ (P O _)_.
Исходные вещества, реактивы и оборудование: магний оксид, хлоридная кислота, растворы: натрий хлорид, натрий карбонат, ортофосфорная кислота; штатив с пробирками.
Задание № 2. «Долина ионов». Напиши формулы ионов, которые входят в состав таких веществ: магний нитрат, магний карбонат магний ортофосфат, магний хлорид, используя при этом химические символы.
Внимание! Для получения необходимого результата при проведении реакций обмена добавляйте растворы реагентов по каплям, избегая избыта. Так можно предотвратить побочные реакции между реагентами, который используется в данном опыте, и избытком реактива из предыдущего опыта.
Задание № 3. «Найди реактив». В таблицу записывай формулы реактивов для осуществления последовательных превращений:
Задание № 4. «Оформлялки». Осуществи практические реакции исходя из задания № 1, свои действия, наблюдения, выводы и уравнения реакции записывай в таблицу:
| Опыт 1. Осуществи превращения MgO Mg Cl _ |
||
| Уравнение реакции:… Это реакция - …(указать тип реакции) |
||
| Опыт 2. Осуществление превращения Mg Cl _ Mg C O _ |
||
| Уравнение реакции: … Уравнение побочной реакции: …. Это реакция - …(указать тип реакции) |
||
| Опыт 3. Осуществление превращения Mg C O _ Mg Cl _ |
||
| Уравнение реакции: … Это реакция - …(указать тип реакции) |
||
| Опыт 4. Осуществление превращения Mg Cl _ Mg _ (P O _)_. |
||
| Уравнение реакции: … Это реакция - …(указать тип реакции) |
||
| Общий вывод: во время практической работы я… |
Тест по правилам техники безопасности

А) это эстетично
Б) наличие грязи может сказаться на проведении эксперимента
В) цвет осадка может измениться
Г) не имеет значения
Почему избыток вещества (реактива) нельзя сливать (ссыпать) обратно в склянку?
Почему избыток вещества (реактива) нельзя сливать (ссыпать) обратно в склянку?
А) можно перепутать вещества
Б) загрязнить вещество
В) запачкать руки
Г) трудно открыть пробки
Проводить опыты, не предусмотренные инструкцией:
А) не разрешается
Б) можно с согласия учителя
В) можно, если знаешь, что получится
При попадании на кожу раствора щелочи необходимо:
А) смыть холодной водой
Б) обработать 2 % раствором соды
В) обработать 2 % раствором уксусной кислоты
Как оформляются результаты практической работы:
А) на отдельном листочке
Б) в тетради для практических работ
В) в рабочей тетради
Пробирку в пробиркодержателе закрепляют
А) на середине пробирки
Б) у отверстия пробирки
В) в нижней части пробирки
Г) не имеет значения

Практические работы
для 9 класса







Дата «___» ___________
Практическая работа №1
Приготовление раствора с определенной массовой
долей растворенного вещества
Цель: закрепить знания и навыки в решении расчетных задач; формирование умений готовить растворы с определенной массовой долей растворенного вещества; формирование практических навыков в работе с измерительными приборами.
Оборудование: химические стаканы объемом 500 мл, стеклянная палочка с резиновым наконечником, весы с разновесами, лопаточка, мерный стакан.
Реактивы: соль, вода (холодная и горячая).
Ход работы

Почему растворение соли происходит быстрее в горячей воде, чем в холодной?
Почему морская вода кипит при более высокой температуре, чем вода дистиллированная?
Вывод: для приготовления __________ г раствора _________ с массовой долей соли _______% необходимо__________________________________
Контрольные вопросы
Почему растворение соли происходит лучше в горячей воде, чем в холодной?
Почему растворение называют физико – химическим процессом?
Какая вода закипит быстрее: морская или дистиллированная?

Дата «___» ___________
ПРАКТИЧЕСКАЯ РАБОТА № 2
«РЕАКЦИИ ОБМЕНА МЕЖДУ РАСТВОРАМИ ЭЛЕКТРОЛИТОВ»

Цель: изучить практически условия, при которых возможны реакции ионного обмена между растворами электролитов.
Оборудование: штатив с пробирками
Реактивы: растворы NaOH , HCl , CuSO 4, BaCl 2 ,Na 2 CO 3, Na 2 SO 3 , фенолфталеин.
Инструктаж по правилам безопасности :
Аккуратно брать растворы в нужных количествах веществ.
Особую осторожность проявлять при работе с растворами кислот НСl , и щелочи,
NaOH
Бережно обращаться со стеклянной посудой.
Ход работы
Общий вывод:
Электролиты-это_________________________________________ к ним относятся___________________________________________________________
Ионные реакции-реакции____________________________________________
Реакции ионного обмена в растворах электролитов протекают до конца в таких случаях:_____________________________________________________________


Дата «___» ___________
ПРАКТИЧЕСКАЯ РАБОТА № 3
Решение экспериментальных задач
Цель : научиться на практике решать экспериментальные задачи, последовательно получать неорганические вещества (нерастворимый гидроксид, оксид и т.д.),распознавать неорганические вещества по их химическим свойствам.
Оборудование и реактивы: пробирки, пробиркодержатель, сухое горючее, штатив для пробирок, спички; купрум сульфат, барий хлорид, натрий карбонат, натрий сульфит, хлоридная кислота, натрий гидроксид или калий гидроксид, индикаторы.
Ход работы
При выполнении работы пользуйтесь таблицей растворимости веществ, таблицей определением ионов.
Опыт № 1. Последовательное получение неорганических веществ.
Практически осуществить такие превращения: купрум (2) сульфат – купрум (2) гидроксид-купрум (2) оксид – купрум хлорид.
Выполнение задания разбейте на этапы.
Общий вывод: мы научились во время выполнения опытов…
Дополнительное задание - экспериментальная задача.
Выдано раствор соли феррум (3) хлорида. Докажите экспериментально, что в состав соли входят катионы феррума и анионы хлора. Напишите уравнения реакции в ионных формах.

Дата «___» ___________
ПРАКТИЧЕСКАЯ РАБОТА № 4
Свойства уксусной кислоты
Цель: изучить и экспериментально подтвердить свойства уксусной кислоты
Реактивы: стружка или порошок магния или цинка, кристаллический натрий карбонат (сода), растворы: уксусная кислота, феррум (3) хлорид, индикаторы, натрий гидроксид.
Оборудование: пробирки, штатив для пробирок, ложка для сухого вещества.
Внимание!


Ход работы
Общий вывод:
« Репортаж с места события »
Сегодня на уроке я узнал …
Я удивился …
Теперь я умею …
Я хотел бы …
Задание «Отвечай – ка»
1. Какие свойства неорганических кислот имеет уксусная кислота?
2. Какие из карбоновых кислот вы используете в нашей жизни. Их физиологическое действие на организм.
Задание «Исправляй - ка»
Исправьте ошибки и расставьте коэффициенты

Дата «___» ___________
ПРАКТИЧЕСКАЯ РАБОТА № 5
Решение экспериментальных задач по органической химии
Цель: закрепить знания об органических соединениях и научиться экспериментально подтверждать и определять вещества с помощью качественных реакций.
Оборудование: штатив с пробирками, сухое горючее, химический стакан, стеклянная палочка.
Реактивы: раствор йодной настойки, лакмус, купрум (11) сульфат, раствор щелочи, крахмал, уксусная кислота, глицерин, яичный белок.
Ход работы
Уравнения реакций:
Определение крахмала____________________________
Определение глицерина___________________________
Определение уксусной кислоты_____________________
Определение белка________________________________
Определение натрий ацетата________________________
Общий в ывод :____________________________________________
Задание – экспериментальная задача :
Докажите экспериментально, что:
А) картофель и белый хлеб содержат крахмал;
Б) спелое яблоко содержит глюкозу.
Составьте перечень реактивов и оборудования, которые вам будут нужны для проведения, план действий по опытам.

Практические работы
в 10 классе

Дата «___» ___________
Практическая работа № 1
Получение углекислого газа и изучение его свойств
Цель: научиться распознавать неорганические вещества, получать углекислый газ из мрамора, работать с кислотами, проводить качественную реакцию на карбонат – ион.
Оборудование и реактивы: пробирка, воронка, газоотводная трубка, штатив, пинцет, химический стакан, мрамор или мел , хлоридная кислота, кристаллический натрий гидрогенкарбонат (сода), индикаторы и др.
Правила Техники безопасности:
Следует соблюдать правила работы с растворами кислот. Не допускать попадания кислот с на кожу и слизистые оболочки.
Соблюдать правила работы с кислотами и ядовитыми веществами – хлоридом бария и нитратом серебра. Остерегаться попадания на кожу и слизистые оболочки.
Ход работы

Задание “Верные и неверные утверждения”.
Утверждения
1. Углекислый газ – это “дикий газ”.
2. В морях и океанах содержится в 60 раз больше углекислого газа, чем в земной атмосфере.
3. Природные источники углекислого газа называются мофетами.
4. В окрестностях Неаполя находится “Собачья пещера”, в которой не могут находиться собаки.
5. В лабораториях углекислый газ получают действием серной кислоты на куски мрамора.
6. Углекислый газ – это газ без цвета и запаха, легче воздуха, хорошо растворим в воде.
7. Твёрдый углекислый газ получил название “сухого льда”.
8. Известковая вода – это раствор гидроксида кальция в воде.

| Общий вывод: Карбон (IV ) оксид получают путем … Карбон (IV ) оксид распознают с помощью … Карбонаты превращаются в гидрогенкарбонаты при таких условиях: … Гидрогенкарбонаты превращаются в карбонаты при таких условиях: … |
Задание учителя. Ответить на вопросы.
Почем у реакции между карбонатами и кислотами называются качественными?
Можно ли испарить соль кальций гидрогенкарбоната из раствора? Почему?
Дата «___» ___________
Практична робота № 2
РОЗВ"ЯЗУВАННЯ ЕКСПЕРИМЕНТАЛЬНИХ ЗАДАЧ
Мета : Розв"язати експериментальні задачі на добування, визначення та доведення властивостей речовин, застосовуючи теоретичні знання та практичні навички на практиці.
Реактиви та обладнання:
розчини ферум (II ) сульфату, хлоридної кислоти, натрій гідроксиду, кальцій гідроксиду, барій хлориду, пронумеровані тверді зразки натрій хлориду, калій хлориду і барій хлориду, твердий натрій сульфат із домішками магній сульфату, стальний дріт, мідь, купрум (ІІ) оксид, що містить домішки порошкоподібного заліза. колба з колодязною водою, нагрівний прилад, пробірки, пробіркотримач, сірники.
Хід роботи
| Задача 1 |
Експериментально встановіть, чи взаємодіє ферум (ІІ) сульфат з:
а) лугом; б) міддю; в) барій хлоридом.
Розв"язання
А. В пробірку наливаємо 1мл розчину ферум (ІІ) сульфату і додаємо 1 мл розчинної основи – натрій гідроксиду. Реакція обміну, що відбувається в пробірці, може бути виражена рівнянням:
Fe S0 4 + 2NaOH -- > Na 2 S0 4 + …
Fe 2+ + S0 4 2- + 2Na + + 2OH - -- > 2Na + + S0 4 2- + …
Fe 2+ + 2OH - -- > … Випадає осад білого кольору.
На повітрі забарвлення стає зеленкуватим і далі бурим.
Б. В другу пробірку поміщаємо кілька шматочків мідного дроту, який попередньо очистили від оксидної плівки. Додаємо 2 мл концентрованого розчину ферум (ІІ) сульфату. Змін не спостерігаємо.
Fe S 0 4 + Cu -/- >
Мідь, як менш активний метал не відновлює залізо із розчину солі.
В. В третю пробірку наливаємо 1мл розчину ферум (ІІ) сульфату і додаємо краплями розчин барій хлориду. Спостерігаємо утворення білого дрібнокристалічного осаду:
Fe S 0 4 + B аСІ 2 -- > Fe СІ 2 + BaS 0 4 ↓
Fe 2+ + S 0 4 2 ─ + Ba 2 + + 2Cl ─ -- > Fe 2+ + 2Cl ─ + BaS 0 4 ↓
S0 4 2 ─ + Ba 2 + -- > BaS0 4 ↓
| Задача 2 |
Доведіть, що виданий вам порошкоподібний купрум (ІІ) оксид містить домішки порошкоподібного заліза.
Розв"язання
В пробірку насипаємо трохи порошку та наллємо 2 мл розчину хлоридної кислоти. Чорний порошок купрум (ІІ) оксиду розчиняється, утворюється зелений розчин купрум (ІІ) хлориду. Для прискорення реакції вміст пробірки обережно підігріваємо: Cu 0 + 2 HCI -- > H 2 0 + CuCI 2.
Газ, що виділяється, збираємо в перевернуту дном до гори пробірку.
Підпалюючи газ чуємо характерний хлопок. Отже, цей газ - водень.
Є домішки заліза:
Fe + 2 HCI -- > FeCl 2 + H 2
0 2e 0
Fe + 2 H + + 2 CI ─ -- > Fe 2+ + 2 Cl ─ + H 2 . Прості речовини метали – відновники. Залізо розташоване в ряді активності до водню – заміщує атоми Гідрогену в кислоті. Оксиди ж металів водень не витискують.
| Задача 3 |
Проробіть досліди, за допомогою яких можна встановити тимчасову твердість води.
Розв"язання
Тимчасова жорсткість води – карбонатна, зумовлена вмістом у ній гідрогенкарбонатів кальцію та магнію. Розчинні гідрогенкарбонати виявляємо наступними дослідами. Ділимо досліджувану воду на дві частини.
Першу частину кип"ятимо тривалий час. Розчинні гідрогенкарбонати металів розкладаються до нерозчинних карбонатів:
Me(HCO 3 ) 2 - t o -> MeCO 3 ↓ + H 2 O + CO 2
До другої порції додаємо насичений розчин кальцій гідроксиду. Так само кисла сіль переходить у середню. Таких солей міститься багато, бо розчин стає каламутним.
З часом відстоюється білий осад кальцій карбонату:
Ca (HCO 3) 2 + Са(ОН) 2 --> 2CaCO 3 ↓ + 2H 2 O
Ca 2+ + 2HCO 3 ─ + Са 2+ + 2ОН ─ --> 2CaCO 3 ↓ + 2H 2 O
| Задача 4 |
Доведіть, що виданий вам твердий натрій сульфат містить домішки магній сульфату.
Розв"язання
Взаємодія натрій гідроксиду і чистого натрій сульфату – реакція зворотна, не іде до кінця. Видимих змін не відбувається:
Na 2 SO 4 + 2Na ОН < -- > 2Na ОН + Na 2 SO 4
2Na + + SO 4 2─ + 2Na + + 2ОН ─ <- -- > 2Na + + 2ОН ─ + 2Na + + SO 4 2─
Для виявлення йона Mg 2+ використаємо реакцію утворення важкорозчинної сполуки. Магній у вигляді білого аморфного осаду Mg (ОН) 2 осаджують їдкі луги Наприклад розчин їдкого натру:
MgSO 4 + 2Na ОН - -- > Na 2 S O 4 + Mg (ОН) 2 ↓ .
Mg 2+ + SO 4 2 ─ + 2Na + + 2ОН ─ - -- > 2Na + + S O 4 2 ─ + Mg (ОН) 2 ↓
Mg 2+ + 2ОН ─ - -- > Mg (ОН) 2 ↓
При дослідженні виданої нам суміші було виявлено домішки. Розчин помутнів. Із завису відстоявся осад магній гідроксиду.
| Задача 5 |
Розпізнайте (не вдаючись до розчинення, а скориставшись відкритим полум"ям нагрівного приладу) тверді зразки натрій хлориду, калій хлориду і барій хлориду.
Розв"язання
Для кожної солі окремо необхідно підготувати очищений багаторазовим промиванням в соляній кислоті й прожарюванням дріт (бажано платиновий).
Почергово на дроті вносимо в безбарвне полум"я зразки (кілька кристаликів) солей, що видані нам під номерами. Катіони металів у вигляді летких сполук забарвлюють полум"я в різні кольори. Перша сіль містить йони Натрію – в найбільш гарячій, верхній частині спостерігаємо яскраво-жовтий колір.
Жовті спалахи при другій спробі вказують теж на домішки сполук натрію, тому для спостереження за полум"ям скористаємось синім (кобальтовим) склом як світлофільтром. Присутність йонів Калію визначаємо за фіолетовою каймою.
Останній зразок солі, при розігріванні у верхній частині полум"я надає йому блідо-зеленого кольору. Робимо висновок про вміст йонів Барію в ньому.
Отже, під №_знаходився натрій хлорид, № _- калій хлорид, № _- барій хлорид.
Додаткове завдання. Підручник О.Г. Ярошенко – 10 клас.
Ферум, як d -елемент з незаповненими d -орбіталями, утворює комплексні сполуки. Іони - донори електронів встановлюють з атомами феруму ковалентні зв"язки за донорно-акцепторним механізмом.
Комплексними сполуками феруму є гексаціаноферат (II ) К 4 - жовта кров"яна сіль і гексаціаноферат (III ) калію К 3 - червона кров"яна сіль (див. також підручник стор. 186) , гексатіоціаноферат (III ) калію К 3 , тетрахлорофератна (III ) кислота Н , октагідроксиферат (III ) калію К 3 тощо.
Під час взаємодії солей заліза (II ) з гексаціанофератом (III ) калію утворюється осад синього кольору - турнбулева синь :
3Fe 2+ + 2 3 ─ - => Fe 3 2 .
У результаті реакції солей Fe (III) з гексаціанофератом (II) калію також утворюється осад синього кольору - берлінська лазур:
4Fe 3+ + 3 4─ => Fe 4 3 .
Під час взаємодії солі феруму (III) з тіоціанатом (роданідом) амонію NH 4 SCN або калію KSCN утворюється сполука темно -червоного кольору - тіоціанат (роданід) феруму (III ):
FeCl 3 + 3KSCN => 3KCl + Fe (SCN) 3 ;
«Роданід заліза (III )»
Fe 3+ + 3SCN ─ - => Fe (SCN ) 3 .
У разі надміру тіоціанат-іонів SCN - утворюється гексатіоціаноферат (III ) калію червоного кольору:
Fe (SCN) 3 + 3SCN ─ => 3─
Наведені рівняння відображають якісні реакції на іони ферум (II ) та (III ). Гексаціаноферат (II ) калію К 4 та тіоціанати лужних металів або алюмінію є реактивами на ферум (ІІІ)-іон, гексаціаноферат (III ) калію К 3 - на ферум (ІІ)-іон.
Дослідіть видані вам сполуки Феруму (ІІ) і (ІІІ), використовуючи наявні реактиви за вище зазначеними якісними реакціями.
Результати дослідів занесіть в таблицю:
| Fe 2+ | Fe 3+ |

Практические работы
для 11 класса

Чай и вкусный бутерброд 
Очень просятся в твой рот.
Не обманывай себя -
Есть и пить у нас нельзя!
Это, друг, химкабинет,
Для еды условий нет.
Пусть в пробирке пахнет воблой,
В колбе - будто мармелад,
Вещества на вкус не пробуй!
Сладко пахнет даже яд.
Как же нюхать вещества?
В колбу нос совать нельзя!
Что может случиться?
Ты можешь отравиться!
Хочешь весел быть и рад –
Надевай всегда халат!
Голова вдруг твоя закружилась,
Руки будто бы не твои.
Если такое случилось,
Учителю тут же скажи.
Всем поможет, ободрит,
Наш учитель Айболит!
Вдруг попал тебе на кожу
Ядовитый химикат:
Срочно смой его водою,
Не то будешь сам не рад!
Вдруг оставили спиртовку
В открытом виде на столе.
Закрой ее без промедленья,
Не то сгоришь ты на огне!
Мой свою посуду чисто
После опытов всегда,
И другие ребятишки
Не осудят никогда.
Нюхать нужно осторожно,
И при том, махнув рукой,
И тогда не будет плохо
У ребенка с головой.
Если на руку попала
Капля жидкости какой,
Поспеши промыть то место
Ты холодною водой!
Прежде чем начать работать,
Парту надо расчищать,
А не то учебник будет
Под рукой тебе мешать!
Войдя в химический наш кабинет,
Не нарушай учителей совет:
И если даже ты не трус,
Не пробуй вещества на вкус!
И нюхать их не думай ты.
Пойми, что это не цветы!
Ничто руками не бери,
Ожег получишь, волдыри!
Посуду грязную помой,
Ну а потом иди домой!
Мы работаем по парам,
Чтобы не обдало жаром,
Ты пробирку отверни
От соседа впереди.
Всю сначала прогревай,
Уголочком наклоняй,
А потом – сильнее там,
Где есть место веществам!
Мы растворчик подогрели,
Вещества у нас вскипели.
Надо пламя укротить
И спиртовочку закрыть!
Остатки слив без разрешенья,
Ты не получишь утешенья.
Реакция начаться может,
Тогда никто уж не поможет.
Рукой не трогай реактивы –
Начнутся страшные нарывы.
А коль коснешься кислоты,
О, скоро пожалеешь ты!
В кабинете химии
Много всяких штучек:
Колбочки, пробирки,
Воронка и штатив.
И тянуть не нужно
Понапрасну ручек,
А то прольешь случайно
Ценный реактив!
Дата «___» ___________
Практич на р о бота № 1
Видалення забруднень органічного походження з поверхні тканини .
Мета: показати вміння застосовувати теоретичні знання на практиці та рівень практичних навичок під час виконання хімічного експерименту; навчитись видаляти забруднення органічного походження з поверхні тканини; повторити правила техніки безпеки.
Реактиви та обладнання: клаптики тканини із забрудненнями різного органічного походження; розчини: рідина для зняття лаку, етанол, нашатирний спирт, гліцерол;, мило, синтетичний мийний засіб; крохмаль, пробірки, пробірко тримач, нагрівальний прилад, сірники, вата, фаянсові чашки, хімічні стакани, фільтрувальний папір.
Хід роботи
Варіант І
Завдання 1. Видаліть пляму від лаку для нігтів.
Завдання 2. Видаліть пляму від вершкового масла.
Завдання 3. Видаліть пляму від пасти кулькової ручки.
Завдання 4. Видаліть пляму від трави.
Висновок
Спосіб видалення плями залежить від кількох чинників: типу забруднюючої речовини, типу тканини, давності забруднення. Свіжі плями, особливо рослинного походження, видаляти можливо із меншими зусиллями. Але всі плями від забруднення органічними сполуками можна вивести за допомогою органічних розчинників, дотримуючись правил техніки безпеки.
Варіант ІІ
Завдання 1. Видаліть пляму від губної помади.
Завдання 2. Видаліть пляму від шоколаду.
Завдання 3. Видаліть пляму від соку чорної смородини.
Завдання 4. Видаліть пляму від чаю.
Висновок
Спосіб видалення плями залежить від кількох чинників: типу забруднюючої речовини, типу тканини, давності забруднення. Свіжі плями, особливо рослинного походження, видалити можна із меншими зусиллями. Але всі плями від забруднення органічними сполуками можна видалити органічними розчинниками, дотримуючись правил техніки безпеки.




Рыбакова Л.Ю., учитель химии
ПЛАН-КОНСПЕКТ УРОКА
Тема урока: ФИО Рыбакова Лариса Юрьевна Место работы: МОУ «СОШ п. Динамовский Новобурасского района Саратовской области» Должность: учитель Предмет: химия Класс: 8Тема и номер урока в теме: Урок « Практическая работа № 1. Приемы обращения с лабораторным оборудованием» является третьим в разделе «Введение».
Изучение раздела «Введение» предусматривает формирование у учащихся общеучебных умений, навыков и ключевых компетенций с использованием метапредметного подхода. В этом направлении приоритетами являются: использование для познания окружающего мира различных методов (наблюдение, измерение, опыты, эксперимент); проведение практической работы, несложных экспериментов и описание их результатов; соблюдение норм и правил поведения в химических лабораториях.
Базовый учебник О.С. ГабриелянЦель урока : формирование системы знаний о правилах техники безопасности в химической лаборатории, об использовании лабораторного оборудования и умений работы с ним для проведения исследования.
Задачи:
Образовательная: познакомить учащихся с лабораторным оборудованием; сформировать навыки умения работы с лабораторным оборудованием, умение проводить исследования для получения нужной информации.
Развивающая: развивать умение планировать решение задачи и выстраивать цепочку действий, умение проводить аналогии, работать с источником информации.
Воспитательная: развивать навыки делового сотрудничества; формировать положительное отношение к учебной деятельности.
Универсальные учебные действия, формируемые в ходе урока:
Личностные: самоопределение, смыслообразование.
Регулятивные: целеполагание, планирование, коррекция, оценка.
Познавательные: общеучебные (формулирование познавательной цели, поиск и выделение необходимой информации, осознанное построение речевого высказывания, создание алгоритмов деятельности при решении проблемы); логические (анализ, сравнение, установление причинно-следственных связей)
Коммуникативные : умение работать в группе со сверстниками для поиска нужной информации, умение слушать и вступать в диалог, коррекция действия партнера.
Ожидаемые результаты
Учащиеся должны знать:
правила ТБ при работе в химической лаборатории;
операции химического эксперимента;
устройство простейших химических приборов;
Учащиеся должны уметь:
обращаться с лабораторным оборудованием, соблюдать правила техники безопасности при выполнении практических работ и домашнего эксперимента;
использовать метод наблюдения при выполнении различных видов практических заданий;
оформлять результаты наблюдений и проведенного эксперимента;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни
работать индивидуально, в парах, используя полученные знания;
обладать навыками работы с различными видами источников информации: литературой, мультимедийными пособиями.
Тип урока: урок усвоения новых знаний
Формы работы учащихся: практическая работа
Необходимое техническое оборудование: компьютер, экран, мультимедийный проектор.
Структура и ход урока
Этап урока
1. а) Подводит учащихся к осознанию важности соблюдения правил ТБ. б) Знакомит с правилами техники безопасности в химической лаборатории и правилами оказания первой помощи с комментариями. Приложение №2 в ) организует работу с ЭОР: интерактивное задание2. Организуетпрактическую работу «Приемы обращения с лабораторным оборудованием» 1) Опыт № 1 « Знакомство с образцами химической посуды» а) задает вопросы, актуализируя жизненный опыт б) демонстрирует предметы лабораторного оборудования (имеющиеся в наличии и со слайдов) в) обеспечивает учащихся технологическими картами. Приложение №3 Инструктивная карта № 1 в) Организует работу с ЭОР – интерактивное задание «Оборудование и посуда для химической лаборатории». 2) Опыт №2 « Приемы обращения с лабораторным штативом» а) Демонстрирует штатив или слайд и дает разъясняющие комментарии по устройству и пользованию штативом.
3) Опыт №3. Приемы обращения со спиртовкой и изучение строения пламени
а) Организует просмотр видеофрагмента, создает условия для деятельности учащихся, организует работу в парах и деловое общение учащихся.
б) обеспечивает учащихся технологическими картами.
Инструктивная карта № 2
Выполняют задание (по количеству компьютеров в классе или 1-2 человека), остальные проверяют правильность выполнения, помогают при необходимости.
Отвечают на вопросы Наблюдают, находят предметы лабораторного оборудования в микролаборатории, фиксируют рисунки в карте, делают выводы об их назначении.
Выполняют задание.
1.Изучают устройство лабораторного штатива. 2.Выполняют задание, указанное в инструкции. 3. Подписывают составные части, делают выводы о назначении штатива.
1.Изучают устройство спиртовки строение пламени. 2.Выполняют задание, указанное в видеофрагменте. 3. Подписывают составные части, делают выводы о назначении спиртовки, о свойствах зон пламени. 4. Делают вывод по итогам работы.
Приложение к плану-конспекту урока
«Приемы обращения с лабораторным оборудованием»
Перечень электронных образовательных ресурсов, необходимых для проведения урока
Приложение № 1
Вводная беседа ««Научный подход к изучению природы. Наблюдение, опыт, теория»
Х имия на протяжении всей истории человечества побуждала многих писателей и поэтов включать в свои произведения образы, навеянные размышлениями о веществе и его превращениях, эмоциональные описания явлений, процессов.
- Прослушайте отрывок из романа А.С. Пушкина «Евгений Онегин»
- Cкажите, какое физическое явление описал в стихотворении поэт? (Переход воды из одного агрегатного состояния в другое.) С помощью какого метода человек получает знания о природе? (Наблюдение)
Что такое наблюдение? (Наблюдение – это концентрация внимания на познаваемых объектах с целью их изучения.)
Как называется наблюдение, которое проводится в строго контролируемых условиях? (Эксперимент)
Слово «эксперимент» (experimentum) имеет латинское происхождение и на русский язык переводится как «опыт», «проба». Эксперимент позволяет подтвердить или опровергнуть гипотезу, которая родилась из наблюдения. Так формулируется вывод.
Великий Леонардо да Винчи говорил, что науки, которые не родились из эксперимента, этой основы всех познаний, бесполезны и полны заблуждений.
Химия и эксперимент - понятия неразделимые.
Что нужно для проведения химического эксперимента? (Специально оборудованное помещение, которое называют химической лабораторией, лабораторное оборудование, знание правил техники безопасности, химические реактивы)
Как вы думаете, какова тема и цель нашего урока и как мы спланируем нашу работу?
План урока
Знакомство с правилами техники безопасности
Знакомство с лабораторным оборудованием, устройством простейших химических приборов
Простейшие операции химического эксперимента
Приложение № 2
Беседа «Жизнь в опасности без правил безопасности»
Во времена становления химической науки исследователям постоянно приходилось сталкиваться в лабораториях с неприятными сюрпризами - взрывами, выделением ядовитых и дурно пахнущих веществ, химическими ожогами... Как-то раз один знакомый французского химика Шарля Вюрца застал его прохаживающимся под окнами собственной лаборатории. На вопрос о том, что он тут делает, Вюрц нехотя ответил: "Ожидаю результата опыта".
Описанный случай красноречиво показывает беспомощность человека перед неприятными сюрпризами, которые таят в себе разнообразные вещества и химические процессы. Только воплощённое в правилах техники безопасности знание о способах преодоления возможных опасностей может надёжно защитить как опытных исследователей, так и делающих первые шаги в изучении химии школьников, сохранить их силы и здоровье.
Итак, познакомимся с правилами техники безопасности в химической лаборатории.Перед началом эксперимента внимательно ознакомьтесь с инструкциями.
Проводите опыты с веществами, которые указаны учителем.
Не берите для опыта больше веществ, чем это необходимо.
Строго выполняйте указанные учителем меры предосторожности.
Производите опыты только в чистой посуде. Банки и склянки закрывайте теми же пробками или крышками, какими они были закрыты.
Нагревая пробирку с жидкостью, держите её так, чтобы открытый конец её был направлен в сторону от самого себя, и от соседей.
Нюхать вещества можно, осторожно направляя на себя их пары или газы лёгким движением руки.
Запрещается выливать в канализацию растворы и органические жидкости.
Запрещается принимать пищу и напитки.
При химических ожогах пораженное место промывают струей воды из-под крана в течение длительного времени - не менее 15 мин.
При ожогах кислотами накладывают примочки 2%-м раствором карбоната натрия, а при ожогах щелочами - 2%-м раствором уксусной, лимонной или борной кислот.
Приложение № 3
- Знакомы ли вы с предметами лабораторного оборудования, если да, то где вы с ними встречались и каково их предназначение?
Давайте познакомимся с некоторыми предметами лабораторного оборудования. Можно выделить несколько групп лабораторного оборудования:
I группа – стеклянная посуда
II группа – фарфоровая посуда
III группа – нагревательные приборы
IV группа – приборы для фиксации и закрепления посуды
Как вы думаете, каково предназначение стеклянной посуды (фарфоровой посуды, нагревательных приборов, приборов для фиксации и закрепления посуды) в химической лаборатории?
Лабораторное оборудование
Стеклянная посуда может быть сделана из толстого (нетермостойкого) стекла и, соответственно, из термостойкого стекла (тонкостенного).
Посуда из термостойкого стекла используется для проведения операций, сопровождающихся изменением температуры (нагревание, охлаждение)
Посуда из толстого стекла предназначена для хранения реактивов или проведение простейших операций, не сопровождающихся изменением температуры.
Большинство опытов проводят в пробирках. Большие пробирки называются демонстрационными, и ими пользуется учитель, когда показывает опыт.
Пробирки поменьше имеют объем около 15мл. Пробирки, имеющие конусовидную форму, используют для того, чтобы отделять осадки от жидкости с помощью центрифуги.
Если реакция идет при нагревании, то используют пробирки с круглым дном.
Перемешивание веществ в пробирке осуществляется постукиванием или встряхиванием содержимого в пробирке.
- Давайте найдем пробирку в микролаборатории и зафиксируем ее в тетради (учитель на доске).
Литература
- Бабич Л.В.. Балезин С.А. – М.: Просвещение, 1991.-320 с.
Габриелян О. С. учебник для 8 класса.
М. Дрофа, 2011. Габриелян О.С. Остроумов И. Г. Настольная книга учителя. Химия, 8 класс. – М.: Дрофа, 2004 – 278
с
.
Давыдов В.Н., Злотников Э.Г. Техника безопасности при работах по химии.
СПб - М.: САГА - ФОРУМ, 2008. 111 с. Маршанова Г. Л. Техника безопасности в школьной химической лаборатории.
М.: АРКТИ, 2002. Полосин В.С. Практикум по методике преподавания химии – М.: Просвещение, 1989.-224 с.
Практическая работа № 1
по теме: « »
Цель работы:
Оборудование:
Ход работы
1. Устройство штатива
2.Устройство спиртовки
3.Посуда
4.Фильтрование
3. вложить в воронку;
«8 класс»
Практическая работа № 1
по теме: « Правила техники безопасности при работе в химическом кабинете. Приемы обращения с лабораторным оборудованием и нагревательными приборами »
Инструктаж по технике безопасности.
Цель работы: Познакомиться с устройством и основными приемами обращения с лабораторным оборудованием.
Оборудование: Штатив, спиртовка, лабораторная посуда.
Ход работы
1. Устройство штатива (нарисовать штатив, обозначить его составные части)
2.Устройство спиртовки (нарисовать спиртовку, обозначить её составные части)
3.Посуда (нарисовать пробирки, колбы, химический стакан)
4.Фильтрование
1. приготовить фильтровальную бумагу;
2. смочить фильтровальную бумагу;
3. вложить в воронку;
4. жидкость наливают, по стеклянной палочке, направляя её на стенку воронки;
5. фильтрат, стекает по стенке стакана, а не в центр, чтобы не выплёскивался.
Найти в тексте определения фильтрата, осадка и процесса фильтрования.
Практическая работа №2
по теме: « Наблюдения за изменениями, происходящими с горящей свечой, и их описание »
Цель: наблюдать физические и химические явления при горении свечи.
Оборудование: предметное стекло, свеча, спички, сухая пробирка, держатель.
Стекло – хрупкий материал, имеющий малое сопротивление при ударе и незначительную прочность при изгибе. Категорически запрещается использовать посуду, имеющую трещины и отбитые края.
Пробирку закрепляют в держателе так, чтобы от горлышка пробирки до держателя было расстояние 1 – 1, 5 см.
Предметное стекло вначале прогревают полностью, а затем вносят в зону тёмного конуса горящей свечи.
Первая помощь при ожогах:
Первая помощь при порезах:
Опыт №1. Физические явления при горении свечи.
Зажгите свечу. Вы увидите, как начинает таять парафин около фитиля, образуя круглую лужицу. Какой процесс здесь имеет место?
Опыт №2. Обнаружение продуктов горения в пламени.
Возьмите предметное стекло, закрепите в держателе (т/б ), внесите в зону тёмного конуса горящей свечи и подержите 3 – 5 с. Быстро поднимите стекло, посмотрите на нижнюю плоскость. Объясните, что там появилось.
Сухую пробирку закрепите в держателе (т/б ), переверните вверх дном и держите над пламенем до запотевания. Объясните наблюдаемое явление.
Практическая работа № 3
по теме: « Анализ почвы и воды »
Цель: определить состав почвы, научиться фильтровать и выпаривать жидкость.
Оборудование: две пробирки, воронка, бумажный фильтр, стеклянная палочка, предметное стекло, спиртовка, стеклянный цилиндр с водой, пробка, универсальная индикаторная бумага.
Инструкция по технике безопасности:
Предметное стекло закрепляется в держателе у одного из его краёв аккуратно. При этом учитывается, что стекло – хрупкий материал и может треснуть, если на него сильно надавить.
В процессе выпаривания воды из почвенной вытяжки вначале прогревается всё предметное стекло, а затем капля жидкости на нём.
Первая помощь при порезах:
а) в первую очередь, необходимо остановить кровотечение (давящая повязка, пережатие сосуда);
б) если рана загрязнена, грязь удаляют только вокруг неё, но ни в коем случае – из глубинных слоёв раны. Кожу вокруг раны обеззараживают йодной настойкой или раствором бриллиантовой зелени;
в) после обработки рану закрывают стерильной салфеткой так, чтобы перекрыть края раны, и плотно прибинтовывают обычным бинтом;
г) после получения первой помощи обратиться в медпункт.
Первая помощь при ожогах:
Ожог первой степени обрабатывают этиловым спиртом, затем, для снятия болевых ощущений, глицерином и накладывают сухую стерильную повязку. Во всех остальных случаях накладывают стерильную повязку после охлаждения места ожога и обращаются в медпункт.
Опыт №1. Механический анализ почвы.
В пробирку помещена почва. Прилейте к ней воду, объём которой должен быть в 3 раза больше объёма почвы. Закройте пробирку пробкой и тщательно встряхивайте 1 – 2 минуты. Наблюдайте за осадком частиц почвы и структурой осадков. Опишите и объясните свои наблюдения.
Опыт №2. Получение почвенного раствора и опыты с ним.
Приготовьте бумажный фильтр, вставьте его в чистую пробирку и профильтруйте полученную в первом опыте смесь почвы и воды. Перед фильтрованием смесь не следует встряхивать. Почва останется на фильтре, а собранный в пробирке фильтрат представляет собой почвенную вытяжку(почвенный раствор).
Несколько капель этого раствора с помощью стеклянной палочки поместите на предметное стекло и подержите его над пламенем спиртовки (т/б ) до выпаривания воды. Что наблюдаете? Объясните.
Возьмите универсальную индикаторную бумагу, нанесите на неё стеклянной палочкой почвенный раствор. Сделайте вывод по результатам своих наблюдений.
Практическая работа № 4
по теме: « Приготовление раствора сахара и определение массовой доли его в растворе »
Инструктаж по технике безопасности
Цель: научиться взвешивать на лабораторных весах, определять объем жидкости с помощью мерного цилиндра, приготовлять раствор с определенной массовой долей вещества.
Оборудование и реактивы: химический стакан, палочка для перемешивания, мерный цилиндр, лабораторные весы, разновесы; сахар, вода.
Порядок выполнения работы
Рассчитайте массу сахара и массу воды, необходимые для приготовления необходимого вам раствора используя формул:
m (вещества) = m (раствора) · ω(вещества)
m
(H
2
O
) =
m
(раствора) -
m
(вещества)
Расчеты приведите в отчете о практической работе.
Определите объем воды, соответствующий вычисленной массе, используя формулу: V =
m
· ρ.
Помните, что для воды ρ = 1 г/мл.
Расчет приведите в отчете о практической работе.
С помощью мерного цилиндра отмерьте вычисленный объем воды. Перелейте воду в химический стакан.
На лабораторных весах взвесьте вычисленную массу сахара. Всыпьте сахар стакан с водой.
Перемешайте содержимое химического стакана до полного растворения сахара.
Сделайте вывод о том, что необходимо для приготовления раствора с определенной массовой долей растворенного вещества.
Практическая работа № 5
по теме: « Признаки химических реакций »
Цель: рассмотреть примеры химических реакций и выявить их признаки.
Оборудование: пробирки, медная проволока, спиртовка, оксид меди (II), раствор серной кислоты, мрамор, раствор соляной кислоты, растворы хлорида железа (III) и роданида калия, растворы сульфата натрия и хлорида бария.
Инструкция по технике безопасности:
Если зажечь спиртовку сразу же после снятия колпачка, загорается плёнка спирта на горлышке спиртовки как раз на том месте, где колпачок прилегает к горлышку. Пламя проникает под диск с трубкой, и пары спирта внутри резервуара загораются. Может произойти взрыв и выброс диска вместе с фитилём. Чтобы избежать этого, приподнимите на несколько секунд диск с фитилём для удаления паров.Если случится воспламенение паров, быстро отставьте в сторону предметы (тетрадь для практических работ) и позовите учителя.
Зажжённую спиртовку нельзя переносить с места на место, нельзя также зажигать одну спиртовку непосредственно от другой. Для зажигания спиртовки пользуйтесь спичками.
Гасить спиртовку можно только одним способом – накрыть пламя фитиля колпачком. Колпачок должен находиться всегда под рукой.
Кислоты – едкие вещества. Разрушают и раздражают кожу, слизистые оболочки.
Наливать кислоту надо так, чтобы при наклоне склянки этикетка, во избежание её порчи, оказывалась сверху.
Соединения меди в виде пыли при попадании на кожу, особенно в местах микротравм, могут вызвать раздражения, привести к аллергии в лёгкой форме.
Работать с соединениями бария нужно так, чтобы не допустить попадания их в рот, так как они токсичны. Для получения тяжёлого отравления достаточно дозы массой менее 0,5г. После завершения работы тщательно помыть руки с мылом под проточной водой.
Первая помощь при порезах:
а) в первую очередь, необходимо остановить кровотечение (давящая повязка, пережатие сосуда);
б) если рана загрязнена, грязь удаляют только вокруг неё, но ни в коем случае – из глубинных слоёв раны. Кожу вокруг раны обеззараживают йодной настойкой или раствором бриллиантовой зелени;
в) после обработки рану закрывают стерильной салфеткой так, чтобы перекрыть края раны, и плотно прибинтовывают обычным бинтом;
г) после получения первой помощи обратиться в медпункт.
Первая помощь при ожогах:
Ожог первой степени обрабатывают этиловым спиртом, затем, для снятия болевых ощущений, глицерином и накладывают сухую стерильную повязку. Во всех остальных случаях накладывают стерильную повязку после охлаждения места ожога и обращаются в медпункт.
Первая помощь при попадании кислоты на кожу рук:
Попавшие на кожу капли кислоты стряхните и тщательно смойте большим количеством воды, а затем обработайте поражённую поверхность 2% раствором питьевой соды.
Первая помощь при отравлении солями бария:
Промыть желудок 1% раствором сульфата натрия или сульфата магния.
Опыт №1 Прокаливание медной проволоки.
Зажгите спиртовку. Возьмите тигельными щипцами медную поволоку и внесите ее в пламя. Через некоторое время уберите проволоку из пламени. Что наблюдаете?
Опыт №2 Взаимодействие карбоната натрия с соляной кислотой.
Положите в небольшой химический стакан немного карбоната натрия. Налейте в химический стакан столько соляной кислоты, чтобы карбонат натрия покрылся ею. Что наблюдаете?
Зажгите лучину и внесите ее в стакан. Что наблюдаете?
Составьте отчет, заполнив таблицу.
Опыт №3 Взаимодействие хлорида аммония с гидроксидом натрия.
Положите в пробирку немного хлорида аммония. Налейте в пробирку столько раствора гидроксида натрия, чтобы хлорид аммония покрылся ним. Тщательно встряхните. Осторожно понюхайте содержимое пробирки.
Составьте отчет, заполнив таблицу.
Опыт №4 Взаимодействие сульфата меди ( II ) с гидроксидом натрия.
Налейте в пробирку 2 мл раствора гидроксида натрия, а затем добавьте в неё 2-3 капли сульфата меди (II ). Что наблюдаете?
Составьте отчет, заполнив таблицу.
Опыт №5 Взаимодействие гидроксида меди ( II ) с соляной кислотой.
К гидроксиду меди (II ) прилейте немного раствора соляной кислоты. Осторожно встряхните. Что наблюдаете?
Составьте отчет, заполнив таблицу.
Опыт №6 Горение спирта
Налейте в чашку 2 мл этилового спирта. Осторожно подожгите его. Что наблюдаете? Составьте отчет, заполнив таблицу.
Опыт №7 Разложение малахита
Насыпьте в пробирку небольшое количество малахита. Нагрейте его в пламени спиртовки. Что наблюдаете?
Составьте отчет, заполнив таблицу.
| Что делали | Наблюдения | (признак химической реакции) |
Практическая работа № 6
по теме: « Свойства кислот, оснований, оксидов и солей »
Цель: осуществить на практике реакции, характеризующие свойства кислот, оснований, оксидов и солей.
Оборудование и реактивы: штатив с пробирками; серная кислота , фосфорная кислота , цинк , железо , оксид меди (II ) , гидроксид натрия , нитрат серебра , хлорид бария , карбонат натрия , фосфат натрия , хлорид меди (II ) , фенолфталеин.
Инструктаж по технике безопасности:
Ход работы
| Что делали | |
| Опыт 1 |
|
| Опыт 2 |
|
Порядок выполнения работы
Опыт 1. Осуществите реакции, характеризующие свойства раствора серной кислоты:
а) кислота + металл = соль + H 2
б) кислота + основный оксид = соль + Н 2 О
в) кислота + основание = соль + Н 2 О
г) кислота + соль = соль + кислота
Опыт 2 . Проделайте реакции, характеризующие свойства хлорида меди (II ):
а) соль + металл = соль + металл
б) соль + щелочь = основание ↓ + соль
в) соль + кислота = соль + кислота
г) соль + соль = соль + соль↓
Составьте уравнения проделанных реакций в молекулярном и ионном виде.
Практическая работа № 7
по теме: « Решение экспериментальных задач »
Цель: экспериментальным путем осуществить поставленные задачи.
Оборудование и реактивы: штатив с пробирками; сульфат меди (II ) , гидроксид натрия , хлорид бария , сульфат натрия , сульфат магния , карбонат натрия , соляная кислота , фенолфталеин.
Инструктаж по технике безопасности
Ход работы
| Что делали | Наблюдения и уравнения химических реакций | Вывод о типе химической реакции |
| Опыт 1. |
||
| Опыт 2. |
||
Порядок выполнения работы
Опыт 1. Осуществите реакции, схемы которых даны:
а) Ba 2+ + SO 4 2- = BaSO 4
б) CO 3 2- + 2H + = H 2 O + CO 2
в) ОН - + Н + = Н 2 О
В таблицу запишите наблюдения и уравнения реакций в молекулярном полном и сокращенном и ионном виде.
Опыт 2. Пользуясь растворами, находящимися на столе, получите:
а) гидроксид меди (II )
б) карбонат магния
Наблюдения запишите в таблицу. Составьте уравнения реакций в молекулярном, полном и сокращенном ионном виде.
Просмотр содержимого документа
«9 класс»
Практическая работа № 1
по теме: « Осуществление цепочки химических превращений »
Инструктаж по технике безопасности.
Цель работы : Решение экспериментальных задач, состоящих из цепочки превращений.
Оборудование : Штатив с пробирками.
Реактивы (1в.) : Сульфат магния MgSO 4 , щелочь NaOH , хлорид бария ВаCl 2 .
Реактивы (2в.) : Сульфат меди CuSO 4 , щелочь NaOH , соляная кислота HCl , Fe (скрепка).
Вариант 1: MgSO 4 – MgCl 2 – Mg (OH ) 2 - MgSO 4
| Уравнения реакций | ||
| MgSO 4 + Mg 2+ + SO 4 2- + | ||
| MgCl 2 + Mg 2+ + 2Cl - + | ||
| Mg (OH ) 2 + |
Вывод:
Вариант 2: CuSO 4 –Cu (OH ) 2 – CuO – Cu
| Уравнения реакций | ||
| CuSO 4 + | ||
| Cu (OH ) 2 | ||
| CuO + |
Вывод:
Практическая работа № 2






