Постоянная ридберга формула. Экспериментальное определение постоянной ридберга
(R
физическая постоянная (См. Физические постоянные),
введённая И. Ридбергом в 1890 при изучении спектров атомов. Р. п. входит в выражения для уровней энергии (См. Уровни энергии) и частот излучения атомов (см. Спектральные серии). Если принять, что масса ядра атома бесконечно велика по сравнению с массой электрона (ядро неподвижно), то, согласно квантовомеханическому расчёту, R
∞
=
2π 2 με 4 /ch 3
= (109737,3143 ± 0,0010) см -1
(на 1974), где е
и m
- заряд и масса электрона, с
- скорость света, h -
Планка постоянная. При учёте движения ядра масса электрона заменяется приведённой массой электрона и ядра и тогда R i
= R ∞ /(1 + m/Mi
),
где M i -
масса ядра. Для лёгких атомов (водорода H, дейтерия D, гелия 4 He) Р. п. имеет значения (см -1
): R H
= 109677,593; R D
= 109707, 417; R 4He
= 109722,267. Лит.:
Тейлор Б., Паркер В., Лангенберг Д., Фундаментальные константы и квантовая электродинамика, пер. с англ., М.,1972.
- - , число структурных элементов в ед. кол-ва в-ва...
Физическая энциклопедия
- - одна из фундаментальных физических констант; равна отношению газовой постоянной R к Авогадро постоянной NA, обозначается k; названа в честь австр. физика Л. Больцмана...
Физическая энциклопедия
- - , характеризует магн. вращение плоскости поляризации света в в-ве. Названа по имени франц. математика М. Верде, наиболее полно исследовавшего законы магн. вращения...
Физическая энциклопедия
- - число частиц в 1 моле в-ва. Обозначается NA и равна (6,022045...
Химическая энциклопедия
- - фундаментальная физ. постоянная, равная отношению газовой постоянной Rк постоянной Авогадро NA ...
Химическая энциклопедия
- - физ. постоянная k, равная отношению универс. газовой постоянной R к числу Авогадро NA: k = R/NА = 1,3807 х 10-23 Дж/К. Названа по имени Л. Больцмана...
- - число молекул или атомов в 1 моле вещества; NA=6,022?1023 моль-1. Названа по имени А. Авогадро...
Современная энциклопедия
- - число молекул или атомов в 1 моле вещества, NА = 6,022045 х 1023моль-1; назв. по имени А. Авогадро...
Естествознание. Энциклопедический словарь
- - характеризует вращение плоскости поляризации света в в-ве под действием магн. поля. Угол поворота ф плоскости поляризации света"...
Естествознание. Энциклопедический словарь
- - одна из осн. уннверс. физ. постоянных, равная отношению универс...
Большой энциклопедический политехнический словарь
- - одна из основных физических постоянных, равная отношению универсальной газовой постоянной R к числу Авогадро NA. : k = R/NA. Названа по имени Л. Больцмана...
- - введённая И. Ридбергом в 1890 при изучении спектров атомов. Р. п. входит в выражения для уровней энергии и частот излучения атомов...
Большая Советская энциклопедия
- - физическая постоянная k, равная отношению универсальной газовой постоянной R к числу Авогадро NA: k = R/NA = 1,3807.10-23 Дж/К. Названа по имени Л. Больцмана...
- - физическая постоянная, входящая в формулы для уровней энергии и спектральных серий атомов: , где, М - масса ядра, m и е - масса и заряд электрона, с - скорость света, h - постоянная Планка...
Большой энциклопедический словарь
- - посто"...
Русский орфографический словарь
- - константа...
Словарь синонимов
"Ридберга постоянная" в книгах
Постоянная забота
Из книги Листы дневника. Том 1 автораПостоянная забота Наши комитеты уже спрашивают, каково будет их положение после ратификации Пакта. Некоторым друзьям, может быть, кажется, что официальная ратификация Пакта уже исключает всякую общественную инициативу и сотрудничество. Между тем на деле должно быть как
Постоянная «прокачка»
Из книги Быстрые результаты. 10-дневная программа повышения личной эффективности автора Парабеллум Андрей АлексеевичПостоянная «прокачка» Почему вам будет тяжело удержать себя на нынешнем уровне? Потому что сейчас мы искусственно, за волосы, вытащили вас наверх, приподняли над горами, над деревьями, чтобы вы увидели за ними лес, окрестности, разглядели перспективу…Ваша задача -
«У нас постоянная паранойя»
Из книги Бизнес путь: Yahoo! Секреты самой популярной в мире интернет-компании автора Вламис Энтони«У нас постоянная паранойя» Эти слова Джерри Янг сказал репортеру Christian Science Monitor еще в 1998 году. Это чувство никуда не делось, и не без причины, как мы покажем позже.Трудно отделить паранойю от культуры этой компании. Она была у них с самого начала. И возможно, именно она
Постоянная забота
Из книги Врата в будущее (сборник) автора Рерих Николай КонстантиновичПостоянная забота Наши комитеты уже спрашивают, каково будет их положение после ратификации Пакта? Некоторым друзьям, может быть, кажется, что официальная ратификация Пакта уже исключает всякую общественную инициативу и сотрудничество. Между тем на деле должно быть как
Постоянная радость
Из книги Большая книга женского счастья автора Блаво РушельПостоянная радость Внезапно, без всякой причины, вы испытываете радость. В обычной жизни вы радуетесь, если на это есть какая-то причина. Встретили красивого мужчину и радуетесь этому; неожиданно вам перепали деньги, в которых вы нуждались, и вы радуетесь; купили дом с
Постоянная Забота
Из книги О Вечном… автора Рерих Николай КонстантиновичПостоянная Забота Наши комитеты уже спрашивают, каково будет их положение после ратификации Пакта? Некоторым друзьям, может быть, кажется, что официальная ратификация Пакта уже исключает всякую общественную инициативу и сотрудничество. Между тем на деле должно быть как
Формула Ридберга - эмпирическая формула, описывающая длины волн в спектрах излучения атомов химических элементов. Предложена шведским учёным Йоханнесом Ридбергом и представлена 5 ноября 1888 года.
Формула Ридберга для водородоподобных элементов выглядит следующим образом:
Длина волны света в вакууме;
Постоянная Ридберга для рассматриваемого химического элемента;
Атомный номер, или число протонов в ядре атома данного элемента;
И - целые числа, такие что .
27) Атом водорода: по Томсону, Бору
Модель Бора
 Боровская модель водородоподобного атома (Z - заряд ядра), где отрицательно заряженный электрон заключен в атомной оболочке, окружающей малое, положительно заряженное атомное ядро. Переход электрона с орбиты на орбиту сопровождается излучением или поглощением кванта электромагнитной энергии (hν
).
Боровская модель водородоподобного атома (Z - заряд ядра), где отрицательно заряженный электрон заключен в атомной оболочке, окружающей малое, положительно заряженное атомное ядро. Переход электрона с орбиты на орбиту сопровождается излучением или поглощением кванта электромагнитной энергии (hν
).
Полуклассическая модель атома, предложенная Нильсом Бором в 1913 г. За основу он взял планетарную модель атома, выдвинутую Резерфордом. Однако, с точки зрения классической электродинамики, электрон в модели Резерфорда, двигаясь вокруг ядра, должен был бы излучать непрерывно, и очень быстро, потеряв энергию, упасть на ядро. Чтобы преодолеть эту проблему Бор ввел допущение, суть которого заключается в том, что электроны в атоме могут двигаться только по определенным (стационарным) орбитам, находясь на которых они не излучают, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. Причем стационарными являются лишь те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка: .
Используя это допущение и законы классической механики, а именно равенство силы притяжения электрона со стороны ядра и центробежной силы, действующей на вращающийся электрон, он получил следующие значения для радиуса стационарной орбиты R n и энергии E n находящегося на этой орбите электрона:
Здесь m e - масса электрона, Z - количество протонов в ядре, - диэлектрическая постоянная, e - заряд электрона.
Именно такое выражение для энергии можно получить, применяя уравнение Шрёдингера, решая задачу о движении электрона в центральном кулоновском поле.
Радиус первой орбиты в атоме водорода R 0 =5,2917720859(36)×10 −11 м, ныне называется боровским радиусом, либо атомной единицей длины и широко используется в современной физике. Энергия первой орбиты E 0 = − 13.6 эВ представляет собой энергию ионизации атома водорода.
28) Опыт Франка Герца
Суть опытов, предложенных и проведенных Франком и Герцем в 1913 году, состояла в нахождении потенциалов ионизации атомов ртути, т.е. в определении энергии ускоренного электрона в наполненной парами ртути трехэлектродной лампе, который, сталкиваясь с атомом ртути, мог отщепить слабосвязанный с ним внешний (валентный) электрон. Заметим, что в том же году Н. Бор сформулировал свои постулаты.
Согласно идеям Бора энергия электрона в атоме может принимать непроизвольные значения, а лишь значения из определенного дискретного набора, впоследствии названные энергетическими уровнями. Эти энергетические уровни иногда называют оптическими уровнями, так как при любых переходах между ними поглощаются или излучаются фотоны, длины волн которых лежат в видимой или соседних областях спектра.
Опыт, явившийся экспериментальным доказательством дискретности внутренней энергии атома. Поставлен в 1913 Дж. Франком и Г. Герцем.
 На рисунке приведена схема опыта. К катоду К и сетке C1 электровакуумной трубки, наполненной парами Hg (ртути), прикладывается разность потенциалов V, ускоряющая электроны, и снимается зависимость силы тока I от V. К сетке C2 и аноду А прикладывается замедляющая разность потенциалов. Ускоренные в области I электроны испытывают соударения с атомами Hg в области II. Если энергия электронов после соударения достаточна для преодоления замедляющего потенциала в области III, то они попадут на анод. Следовательно, показания гальванометра Г зависят от потери электронами энергии при ударе.
На рисунке приведена схема опыта. К катоду К и сетке C1 электровакуумной трубки, наполненной парами Hg (ртути), прикладывается разность потенциалов V, ускоряющая электроны, и снимается зависимость силы тока I от V. К сетке C2 и аноду А прикладывается замедляющая разность потенциалов. Ускоренные в области I электроны испытывают соударения с атомами Hg в области II. Если энергия электронов после соударения достаточна для преодоления замедляющего потенциала в области III, то они попадут на анод. Следовательно, показания гальванометра Г зависят от потери электронами энергии при ударе.
В опыте наблюдался монотонный рост I при увеличении ускоряющего потенциала вплоть до 4,9 В, то есть электроны с энергией Е < 4,9 эВ испытывали упругие соударения с атомами Hg и внутренняя энергия атомов не менялась. При значении V = 4,9 В (и кратных ему значениях 9,8 В, 14,7 В) появлялись резкие спады тока. Это определённым образом указывало на то, что при этих значениях V соударения электронов с атомами носят неупругий характер, то есть энергия электронов достаточна для возбуждения атомов Hg. При кратных 4,9 эВ значениях энергии электроны могут испытывать неупругие столкновения несколько раз.
Таким образом, опыт Франка - Герца показал, что спектр поглощаемой атомом энергии не непрерывен, а дискретен, минимальная порция (квант электромагнитного поля), которую может поглотить атом Hg, равна 4,9 эВ. Значение длины волны λ = 253,7 нм свечения паров Hg, возникавшее при V > 4,9 В, оказалось в соответствии со вторым постулатом Бора
![]() ,
,
где E 0 и E 1 - энергии основного и возбужденного уровней энергии. В опыте Франка - Герца, E 0 - E 1 = 4,9 эВ.
29) Волны Луи де Бройля
Волны, связанные с любой микрочастицей и отражающие их квантовую природу.
 ; -позволяет найти длину волны для частицы, которая обладает импульсом р.
; -позволяет найти длину волны для частицы, которая обладает импульсом р.

Для е: ![]() ;
;  1[Ангстрем]=[м].
1[Ангстрем]=[м].
Свойство волн де Бройля.


 ;
;
(фаза скорости волны де Бройля>скорости света); 
30) Принцип неопределённости Гейзенберга
Определение: произведение неопределенностей значений двух сопряженных переменных не может быть по порядку величины меньше, чем постоянная Планка.
Обобщённый принцип неопределённости
Теорема . Для любых самосопряжённых операторов: и , и любого элемента x из H такого, что ABx и BAx оба определены (то есть, в частности, Ax и Bx также определены), имеем:
Это прямое следствие неравенства Коши - Буняковского.
Следовательно, верна следующая общая форма принципа неопределённости , впервые выведенная в 1930 г. Говардом Перси Робертсоном и (независимо) Эрвином Шрёдингером:
Это неравенство называют соотношением Робертсона - Шрёдингера .
Оператор AB − BA называют коммутатором A и B и обозначают как [A ,B ]. Он определен для тех x , для которых определены оба ABx и BAx .
Из соотношения Робертсона - Шрёдингера немедленно следует соотношение неопределённости Гейзенберга :
Предположим, A и B - две физические величины, которые связаны с самосопряжёнными операторами. Если AB ψ и BA ψ определены, тогда:
![]() ,
,
![]()
Среднее значение оператора величины X в состоянии ψ системы, и
Оператор стандартного отклонения величины X в состоянии ψ системы.
Приведённые выше определения среднего и стандартного отклонения формально определены исключительно в терминах теории операторов. Утверждение становится однако более значащим, как только мы заметим, что они являются фактически средним и стандартным отклонением измеренного распределения значений. См. квантовая статистическая механика.
То же самое может быть сделано не только для пары сопряжённых операторов (например координаты и импульса, или продолжительности и энергии), но вообще для любой пары Эрмитовых операторов. Существует отношение неопределённости между напряжённостью поля и числом частиц, которое приводит к явлению виртуальных частиц.
Возможно также существование двух некоммутирующих самосопряжённых операторов A и B , которые имеют один и тот же собственный вектор ψ. В этом случае ψ представляет собой чистое состояние, которое является одновременно измеримым для A и B .
Общие наблюдаемые переменные, которые повинуются принципу неопределённости
Предыдущие математические результаты показывают, как найти отношения неопределённости между физическими переменными, а именно, определить значения пар переменных A и B , коммутатор которых имеет определённые аналитические свойства.
- самое известное отношение неопределённости - между координатой и импульсом частицы в пространстве:
![]()
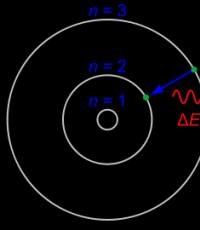
Длины волн излучения атома определенного типа зависят от разности обратных квадратов расстояний между квантовыми числами.
Во второй половине XIX столетия ученые поняли, что атомы различных химических элементов излучают свет строго определенных частот и длин волны, и такое излучение имеет линейчатый спектр , благодаря чему их свет имеет характерную окраску (см. Открытие Кирхгофа—Бунзена). Чтобы убедиться в этом, достаточно взглянуть на уличные фонари. Обратите внимание, что на крупных автомагистралях яркие лампы дневного света имеют обычно желтоватый оттенок. Это следствие того, что они заполнены парами натрия, а в видимом спектре излучения натрия интенсивнее всего проявляются две спектральные линии желтого оттенка.
С развитием спектроскопии стало ясно, что атом любого химического элемента имеет свой набор спектральных линий, по которым его можно вычислить даже в составе далеких звезд, как преступника по отпечаткам пальцев. В 1885 году швейцарский математик Иоганн Бальмер (Johann Balmer, 1825-98) сделал первый шаг в направлении расшифровки закономерности расположения спектральных линий в излучении атома водорода, эмпирически выведя формулу, описывающую длины волн в видимой части спектра атома водорода (так называемая спектральная линия Бальмера ). Водород — самый простой по структуре атом, и поэтому математическое описание расположения линий его спектра было получено раньше всего. Четыре года спустя шведский физик Йоханнес Ридберг обобщил формулу Бальмера, распространив ее на все участки спектра электромагнитного излучения атома водорода, включая ультрафиолетовую и инфракрасную области. Согласно формуле Ридберга, длина световой волны λ, которую излучает атом водорода, определяется формулой
где R — постоянная Ридберга, а n 1 и n 2 — натуральные числа (при этом n 1 n 2). В частности, при n 1 = 2 и n 2 = 3, 4, 5, ... наблюдаются линии видимой части спектра излучения водорода (n 2 = 3 — красная линия; n 2 = 4 — зеленая; n 2 = 5 — голубая; n 2 = 6 — синяя) — это так называемая серия Бальмера . При n 1 = 1 водород дает спектральные линии в ультрафиолетовом диапазоне частот (серия Лаймана ); при n 2 = 3, 4, 5, ... излучение переходит в инфракрасную часть электромагнитного спектра. Значение R было определено экспериментально.
Изначально выявленная Ридбергом закономерность считалась чисто эмпирической. Однако после появления модели атома Бора стало ясно, что она имеет глубокий физический смысл и работает отнюдь не случайно. Рассчитав энергию электрона на n -й орбите от ядра, Бор установил, что она пропорциональна именно -1/n 2).
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«ДОНСКОЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
Кафедра физики
Изучение спектра атома водорода. Определение постоянной ридберга
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ЛАБОРАТОРНОЙ РАБОТЕ №4 ПО ФИЗИКЕ
(раздел «Атомная физика»)
Ростов-на-Дону 2012
Составители: доц. И.В. Мардасова
доц. Н.В. Пруцакова
доц. А.Я. Шполянский
Изучение спектра атома водорода. Определение постоянной Ридберга: метод. указания к лабораторной работе № 4. – Ростов н/Д: Издательский центр ДГТУ, 2012 – 12 с.
Методические указания предназначены для выполнения лабораторной работы студентами всех форм обучения в лабораторном практикуме по физике (раздел «Атомная физика»).
Печатается по решению методической комиссии факультета «Нанотехнологии и композиционные материалы»
Научный редактор канд. ф.-м. наук, проф. Наследников Ю.М.
©Издательский центр ДГТУ, 2012
Лабораторная работа №4
Цель работы: изучение спектрального метода исследования веществ с использованием спектроскопа; определение длин волн спектральных линий атома водорода; расчет постоянной Ридберга.
Приборы и оборудование : монохроматор УМ-2, работающий в режиме спектроскопа; конденсор; неоновая лампа; ртутная лампа ДРШ; водородная трубка; высокочастотный генератор.
Краткая теория
Спектральный анализ – это физический метод определения качественного и количественного состава вещества на основе изучения его спектров. Совокупность частот (или длин волн), содержащихся в излучении вещества, называется спектром испускания данного вещества.
Спектр излучения отдельных атомов состоит из отдельных спектральных линий - линейчатый спектр . Молекулярные спектры в отличие от атомных представляют собой набор полос – полосатый спектр.
В задачу данной работы входит изучение линейчатого спектра испускания водорода в газообразном состоянии с помощью спектроскопа .
Как же возникает линейчатый спектр излучения отдельных атомов водорода? Прежде всего происходит диссоциация молекул на атомы в газовом разряде в результате столкновений свободных электронов с молекулами. Далее соответствующие столкновения свободных электронов с атомами обуславливают переход электрона в атоме на более высокие энергетические уровни. Такое состояние атома или молекулы, возникающее при рекомбинации атомов, не является устойчивым, через время ~10 -8 с электрон вернется на свой энергетический уровень, и атом или молекула испустят квант света - фотон. Основным будет линейчатый спектр испускания атомов водорода, на который может частично накладываться менее интенсивный полосатый спектр молекул водорода.
Согласно второму постулату Бора, энергия фотона, который испускается при переходе электрона в атоме из состояния с номеромm в состояние с номеромn , равна
 ,
,

или
 (1)
(1)
где
 – постоянная Планка,
– постоянная Планка, – частота излучения,
– частота излучения,  –
длина
волны,
–
длина
волны,
 –
скорость
света в вакууме,
–
скорость
света в вакууме, – энергии m
-
го
иn
-
го
состояний соответственно.
– энергии m
-
го
иn
-
го
состояний соответственно.
Из квантовой механики следует, что энергии электронов в атомах могут принимать только определенные дискретные значения. Состояния, отвечающие этим значениям энергии, называются энергетическими уровнями . При переходе электронов на более низкие уровни излучаются спектральные линии . Совокупность линий, отвечающих переходам с различных более высоких уровней на один и тот же нижний уровень, образует спектральную серию .
Наиболее простой является система энергетических уровней атома водорода. Значение энергий электрона в атоме водорода можно вычислить по формуле:
 (n
=1,
2, 3…), (2)
(n
=1,
2, 3…), (2)
где
n
–
главное
квантовое
число
,
 –
масса
электрона,
–
масса
электрона,
 –
заряд
электрона,
–
заряд
электрона,
 – электрическая постоянная. Формула
(2) впервые получена Н. Бором. Для более
сложных атомов эта формула несправедлива.
– электрическая постоянная. Формула
(2) впервые получена Н. Бором. Для более
сложных атомов эта формула несправедлива.
Из (1) и (2) следует, что длины волн спектральных линий атома водорода могут быть рассчитаны по формуле:
 , (3)
, (3)
где
 (4)
(4)
– константа, называемая постоянной Ридберга . Формула (3) называется обобщенной формулой Бальмера .
Из формулы (3) следует, что линии в спектре атома водорода можно расположить по сериям . Для всех линий одной и той же серии значение n остается постоянным, а m может принимать любые целые значения, начиная с (n + 1 ).
В
данной работе изучается серия
Бальмера
– совокупность линий в спектре атома
водорода, соответствующих переходам
со всех вышележащих уровней на уровень
с n
= 2. Только
при n
= 2 и m
= 3, 4, 5, 6 излучаемые фотоны имеют длину
волны  ,
попадающую в видимый
участок спектра. При других значениях
n
и m
фотоны соответствуют инфракрасному
или ультрафиолетовому участкам спектра.
,
попадающую в видимый
участок спектра. При других значениях
n
и m
фотоны соответствуют инфракрасному
или ультрафиолетовому участкам спектра.
Длины
волн  фотонов
видимого участка могут быть вычислены
по
формулам:
фотонов
видимого участка могут быть вычислены
по
формулам:
 – красная линия
– красная линия
 – зелено-голубая линия
– зелено-голубая линия
 – фиолетово-синяя линия
– фиолетово-синяя линия
 – фиолетовая линия
– фиолетовая линия
Массы m ф и импульсы р ф данных фотонов можно найти по формулам:
 (6) и
(6) и
 (7).
(7).
Схема некоторых переходов в атоме водорода приведена на рис. 1.
Напомним смысл обозначений в этой схеме. Наряду с главным квантовым числом n состояние электрона в атоме характеризуется орбитальным квантовым числом l и магнитным квантовым числом m l . Состояния электрона с l = 0,1,2 обозначаются как s - , p - и d - состояния соответственно. Но уровни энергии электрона в атоме (а значит, и длины волн излучения) не зависят от чисел l , m l , а определяются только главным квантовым числом n .
В квантовой механике доказывается, что возможны не любые переходы электронов в атоме, а лишь такие, при которых изменение орбитального квантового числа l соответствует правилу отбора
 . (8)
. (8)
В соответствии с правилом (8), в первых двух сериях в спектре атома водорода разрешены переходы (см. рис. 1):


Рис. 1. Схема электронных переходов в атоме водорода
Rydbergo konstanta statusas T sritis Standartizacija ir metrologija apibrėžtis Apibrėžtį žr. priede. priedas(ai) Grafinis formatas atitikmenys: angl. Rydberg constant vok. Rydberg Konstante, f rus. константа Ридберга, f; постоянная Ридберга, f… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
постоянная Ридберга - Rydbergo konstanta statusas T sritis fizika atitikmenys: angl. Rydberg constant vok. Rydberg Konstante, f; Rydbergsche Konstante, f rus. постоянная Ридберга, f pranc. constante de Rydberg, f … Fizikos terminų žodynas
Постоянная Ридберга величина, введённая Ридбергом, входящая в уравнение для уровней энергии и спектральных линий. Постоянная Ридберга обозначается как R. Эта постоянная была введена Йоханнесом Робертом Ридбергом в 1890 при изучении спектров… … Википедия
Постоянная тонкой структуры, обычно обозначаемая как, является фундаментальной физической постоянной, характеризующей силу электромагнитного взаимодействия. Она была введена в 1916 году немецким физиком Арнольдом Зоммерфельдом в качестве меры… … Википедия
Не следует путать с постоянной Больцмана. Постоянная Стефана Больцмана (также постоянная Стефана), физическая постоянная, являющаяся постоянной пропорциональности в законе Стефана Больцмана: полная энергия, излучаемая единицей площади … Википедия
- (R), фундаментальная физическая константа, входящая в выражения для уровней энергии и частот излучения атомов (см. СПЕКТРАЛЬНЫЕ СЕРИИ); введена швед. физиком Й. Р. Ридбергом (1890). Если принять, что масса ядра атома бесконечно велика по… … Физическая энциклопедия
- (обозначается R) физическая постоянная, входящая в формулы для уровней энергии и спектральных серий атомов: , где, М масса ядра, m и е масса и заряд электрона, с скорость света, h постоянная Планка … Большой Энциклопедический словарь
- (обозначается R), физическая постоянная, входящая в формулы для уровней энергии и спектральных серий атомов: R = R∞/(1 + m/М), где R∞ = 2π2me4/ch3≈1,097373·107 м 1, М масса ядра, т и e масса и заряд электрона, с скорость света, h постоянная… … Энциклопедический словарь
- (обозначается К), физ. постоянная, входящая в ф лы для уровней энергии и спектральных серий атомов: R = Roo/(1 + т/M), где Roo, = 2ПИ2me4/ch3 1,097373*107 м 1, М масса ядра, т и е масса и заряд электрона, с скорость света, h постоянная Планка.… … Естествознание. Энциклопедический словарь
- (R физическая постоянная (См. Физические постоянные), введённая И. Ридбергом в 1890 при изучении спектров атомов. Р. п. входит в выражения для уровней энергии (См. Уровни энергии) и частот излучения атомов (см. Спектральные серии). Если… … Большая советская энциклопедия