Центр узнавания белка лигандом. Понятие о рецепторе и лиганде
Лиганды - это вещества, способные специфически связываться с активным центром молекул определённой структуры.
Биолигандами я предлагаю называть те лиганды, которые осуществляют биорегуляцию в живых организмах за счёт своего связывания с рецепторными молекулами-мишенями. (© Сазонов В.Ф., 2012. © kineziolog.bodhy.ru, 2012.)
Лиганды в биорегуляции (биолиганды) - это фактически сигнальные управляющие вещества, способные передавать управляющие команды за счёт своего связывания с активным центром молекулярных рецепторов, обладающих специфичностью к ним.
Таким образом, можно сказать, что именно биолиганды осуществляют хеморегуляцию , т.е. химическое управление клетками, организмом, его частями или совокупностью организмов.
Механизм действия биолигандов
По влиянию лигандов на конформацию белков белок-лигандные взаимодействия можно разделить на несколько классов.
Взаимодействия класса I:
Лиганд, связываясь с белком, не вызывает существенных изменений конформации, но стабилизирует структуру белка.
Пример - связывание ионов Са2* с лизоцимом. В присутствии лиганда (ионов Са2") для денатурации лизоцима требуются большие концентрации соответствующего агента (мочевины или гуанидингидрохлорида).
Видимо, в данном случае с помощью Са2< образуются дополнительные связи между радикалами.
Взаимодействия класса II:
Лиганд значительно меняет третичную структуру белка, и только в таком состоянии белок становится достаточно активным.
Пример - связывание ионов Са2* с кальмодулином - внутриклеточным рецептором этих ионов. Связав два иона Са2*, кальмодулин приобретает способность влиять на активность многих белков клетки.
Взаимодействия класса III:
В отсутствие лиганда белок находится в т. н. состоянии расплавленной глобулы: имеет достаточно компактную глобулярную форму, но без какой-либо определенной третичной структуры - последняя формируется лишь при связывании лиганда.
Пример такого белка - лактальбумин (компонент ферментного комплекса синтеза лактозы). Это небольшой белок, содержащий 4 дисульфидные связи и прочно связывающий 1 ион Са* . Видимо, данный ион является ключевым структурообразующим элементом. При его удалении третичная структура белка разрушается. Но глобулярная форма и размер глобулы сохраняются благодаря стабилизирующему влиянию дисульфидных связей.
Взаимодействия класса IV:
Без лиганда у белка не до конца сформирована вторичная структура и полностью отсутствует третичная структура. При этом пептидная цепь частично развернута.
Пример белка остеокальцин, содержащийся в матриксе костей. Он содержит всего около 50 аминокислотных остатков и способен связывать 5 ионов Са". Связывание сопровождается существенным уменьшением объема глобулы, формированием третичной структуры и объединением глобул в димеры. Т. е. в данном случае лиганд необходим для появления у белка и четвертичной структуры.
Взаимодействия класса V:
В отсутствие лиганда белковая цепь практически полиостью развернута, т. е. представляет собой случайный клубок. Взаимодействие же с лигандом приводит к полному формированию пространственной структуры белка.
Пример - цитохром с, один из белков цепи переноса электронов в митохондриях. Его лиганд гем (сходный с гемом гемоглобина). Удаление тема приводит к почти полному разворачиванию белковой молекулы.
Взаимодействия класса VI:
Связывание лиганда вызывает масштабные подвижки доменов или субъединиц белка.
Пример - взаимодействие гемоглобина (НЬ) с кислородом. В ходе этого процесса происходят многочисленные и сложные конформационные превращения. В том числе соседние субъединицы поворачиваются друг относительно друга на 10 15".
В результате при связывании молекулы 02 с гемом одной субъединицы повышается сродство к кислороду соседних субъединиц. Это обозначается как кооперативный эффект и имеет большое физиологическое значение.
Завершая данный пункт, сделаем два замечания:
а) во-первых, как видно, лиганды действительно могут очень существенно влиять на конформацию белка;
б) во-вторых, для белка, имеющего несколько лигандов (особенно если последние связываются с разными частями молекулы), характер подобного влияния для разных лигандов может быть совершенно разным.
Например, по-разному воздействуют на структуру гемоглобина такие его лиганды, как гем и кислород.
Поэтому, в отличие от авторов изложенной здесь систематизации (В. Н. Уверского и Н. В. Нарижневой), мы говорили не о классах белков, а о классах белок-лигандных взаимодействий.
), а также в химии комплексных соединений , обозначая там присоединенные к одному или нескольким центральным (комплексообразующим) атомам металла частицы.
В неорганической химии
Чаще всего такое связывание происходит с образованием так называемой «координационной» донорно-акцепторной связи , где лиганды выступают в роли основания Льюиса , то есть являются донорами электронной пары . При присоединении лигандов к центральному атому химические свойства комплексообразователя и самих лигандов часто претерпевают значительные изменения.
Номенклатура лигандов
- первым в названии соединения в именительном падеже называется анион, а затем в родительном - катион
- в названии комплексного иона сначала перечисляются лиганды в алфавитном порядке, а затем центральный атом
- центральный атом в нейтральных катионных комплексах называются русским названием, а в анионах корнем латинского названия с суффиксом «ат». После названия центрального атома указывается степень окисления.
- число лигандов, присоединенных к центральному атому, указывается приставками «моно», «ди», «три», «тетра», «пента», и т. д.
Характеристики лигандов
Электронное строение
Собственно, важнейшая характеристика лиганда, позволяющая оценить и спрогнозировать его способности к комплексообразованию и саморазрушению D-орбитали - разрушения соединения в целом. В первом приближении включает в себя количество электронных пар, которые лиганд способен выделить на создание координационных связей и электроотрицательность донирующего атома или функциональной группы .
Дентатность
Число занимаемых лигандом координационных мест центрального атома (или атомов), называется дентатностью (от лат. dens, dent- - зуб ). Лиганды, занимающие одно координационное место, называются моно дентатными (например, N H 3), два - би дентатными (оксалат-анион [O -C(=O)-C(=O)-O ] 2−). Лиганды, способные занять большее количество мест, обычно обозначают как поли дентатные. Например, этилендиаминтетрауксусная кислота (EDTA), способная занять шесть координационных мест.
Кроме дентатности, существует характеристика, отражающая количество атомов лиганда, связанных с одним координационным местом центрального атома. В английской литературе обозначается словом hapticity и имеет номенклатурное обозначение с соответствующим надстрочным индексом. Хотя устоявшегося термина в русском языке она, по-видимому, не имеет, в некоторых источниках можно встретить кальку «гаптность» . Как пример, можно привести циклопентадиенильный лиганд в металлоцентровых комплексах, занимающий одно координационное место (то есть, являющийся монодентатным) и связанный через все пять атомов углерода: η 5 - − .
Способы координации
 Лиганды с дентатностью больше двух способны образовывать хелатные комплексы
(греч. χηλή
- клешня) - комплексы, где центральный атом включен в один или более циклов с молекулой лиганда. Такие лиганды называются хелатирующими
. Как пример можно привести комплексы тетрааниона той же EDTA, обратив внимание, что несколько из четырёх связей M-O в нём могут формально являться ионными
.
Лиганды с дентатностью больше двух способны образовывать хелатные комплексы
(греч. χηλή
- клешня) - комплексы, где центральный атом включен в один или более циклов с молекулой лиганда. Такие лиганды называются хелатирующими
. Как пример можно привести комплексы тетрааниона той же EDTA, обратив внимание, что несколько из четырёх связей M-O в нём могут формально являться ионными
.
При образовани хелатных комплексов часто наблюдается хелатный эффект - большая их стабильность по сравнению с аналогичными комплексами не-хелатирующих лигандов. Он достигается за счет большего экранирования центрального атома от замещающих воздействий и энтропийного эффекта. Например, константа диссоциации аммиачного комплекса кадмия 2+ почти в 1500 раз меньше, чем комплекса с этилендиамином 2+ . Причина этого заключается в том, что при взаимодействии гидратированного иона кадмия(II) с этилендиамином две молекулы лиганда вытесняют четыре молекулы воды. При этом число свободных частиц в системе значительно возрастает, и энтропия системы возрастает (а внутренняя упорядоченность комплекса соответственно растёт). То есть причина хелатного эффекта - увеличение энтропии системы при замещении монодентатных лигандов полидентатнымии и, как следствие, снижение энергии Гиббса .
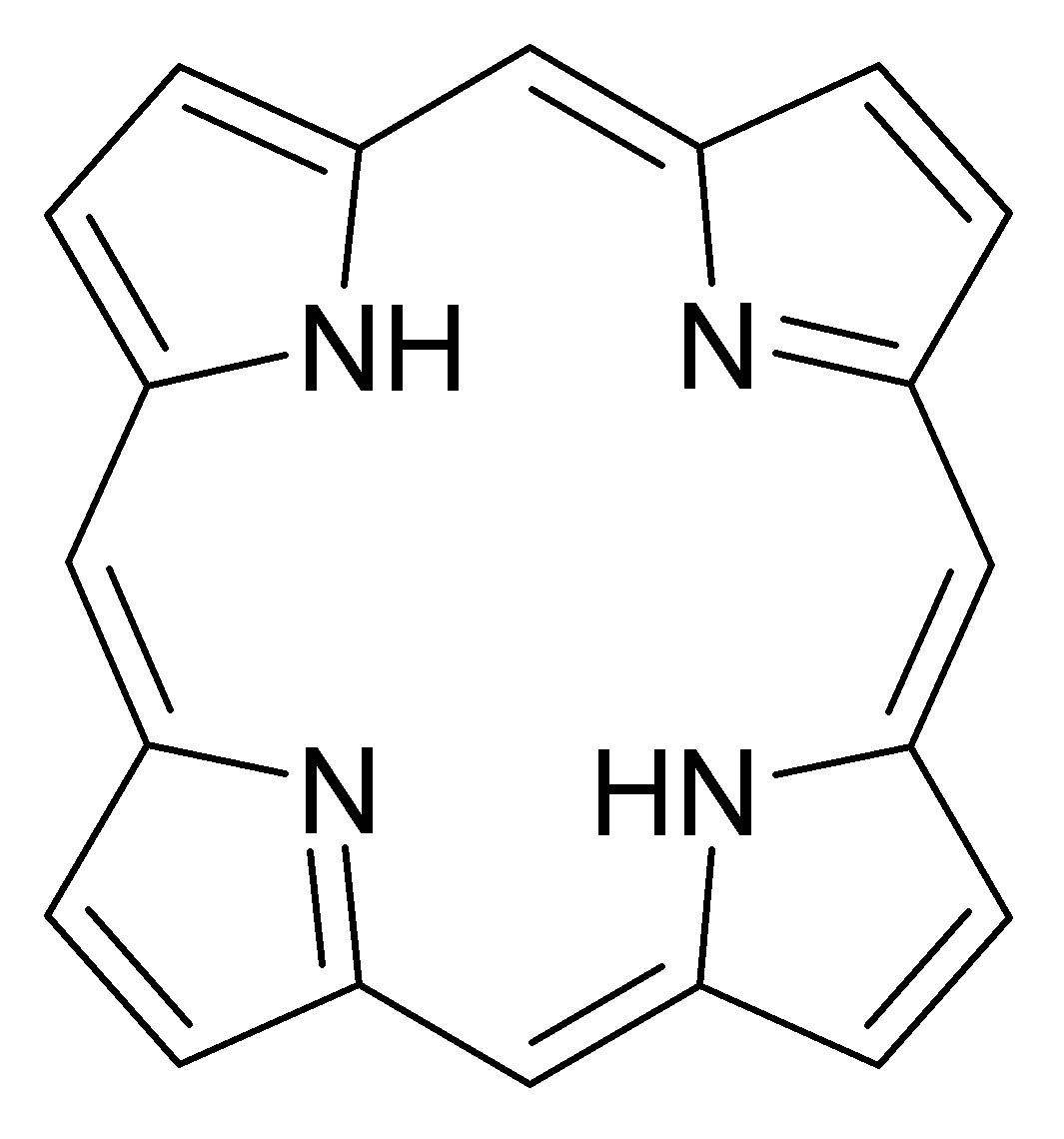 Среди хелатирующих лигандов можно выделить класс макроциклических лигандов - молекул с достаточным для помещения атома комплексообразователя размером внутрициклического пространства. Примером таких соединений могут служить порфириновые основания - основы важнейших биохимических комплексов, таких, как гемоглобин , хлорофилл и бактериохлорофилл . Также в качестве макроциклических лигандов могут выступать краун-эфиры , каликсарены и др.
Среди хелатирующих лигандов можно выделить класс макроциклических лигандов - молекул с достаточным для помещения атома комплексообразователя размером внутрициклического пространства. Примером таких соединений могут служить порфириновые основания - основы важнейших биохимических комплексов, таких, как гемоглобин , хлорофилл и бактериохлорофилл . Также в качестве макроциклических лигандов могут выступать краун-эфиры , каликсарены и др.
Лиганды также могут являться мостиковыми, образуя связи между различными центральными атомами в би- или полиядерных комплексах. Мостиковые лиганды обозначаются греческой буквой μ (мю ).
Напишите отзыв о статье "Лиганд"
Примечания
|
||||||||||||||||||
Отрывок, характеризующий Лиганд
– Ежели бы все воевали только по своим убеждениям, войны бы не было, – сказал он.– Это то и было бы прекрасно, – сказал Пьер.
Князь Андрей усмехнулся.
– Очень может быть, что это было бы прекрасно, но этого никогда не будет…
– Ну, для чего вы идете на войну? – спросил Пьер.
– Для чего? я не знаю. Так надо. Кроме того я иду… – Oн остановился. – Я иду потому, что эта жизнь, которую я веду здесь, эта жизнь – не по мне!
В соседней комнате зашумело женское платье. Как будто очнувшись, князь Андрей встряхнулся, и лицо его приняло то же выражение, какое оно имело в гостиной Анны Павловны. Пьер спустил ноги с дивана. Вошла княгиня. Она была уже в другом, домашнем, но столь же элегантном и свежем платье. Князь Андрей встал, учтиво подвигая ей кресло.
– Отчего, я часто думаю, – заговорила она, как всегда, по французски, поспешно и хлопотливо усаживаясь в кресло, – отчего Анет не вышла замуж? Как вы все глупы, messurs, что на ней не женились. Вы меня извините, но вы ничего не понимаете в женщинах толку. Какой вы спорщик, мсье Пьер.
– Я и с мужем вашим всё спорю; не понимаю, зачем он хочет итти на войну, – сказал Пьер, без всякого стеснения (столь обыкновенного в отношениях молодого мужчины к молодой женщине) обращаясь к княгине.
Княгиня встрепенулась. Видимо, слова Пьера затронули ее за живое.
– Ах, вот я то же говорю! – сказала она. – Я не понимаю, решительно не понимаю, отчего мужчины не могут жить без войны? Отчего мы, женщины, ничего не хотим, ничего нам не нужно? Ну, вот вы будьте судьею. Я ему всё говорю: здесь он адъютант у дяди, самое блестящее положение. Все его так знают, так ценят. На днях у Апраксиных я слышала, как одна дама спрашивает: «c"est ca le fameux prince Andre?» Ma parole d"honneur! [Это знаменитый князь Андрей? Честное слово!] – Она засмеялась. – Он так везде принят. Он очень легко может быть и флигель адъютантом. Вы знаете, государь очень милостиво говорил с ним. Мы с Анет говорили, это очень легко было бы устроить. Как вы думаете?
Пьер посмотрел на князя Андрея и, заметив, что разговор этот не нравился его другу, ничего не отвечал.
– Когда вы едете? – спросил он.
– Ah! ne me parlez pas de ce depart, ne m"en parlez pas. Je ne veux pas en entendre parler, [Ах, не говорите мне про этот отъезд! Я не хочу про него слышать,] – заговорила княгиня таким капризно игривым тоном, каким она говорила с Ипполитом в гостиной, и который так, очевидно, не шел к семейному кружку, где Пьер был как бы членом. – Сегодня, когда я подумала, что надо прервать все эти дорогие отношения… И потом, ты знаешь, Andre? – Она значительно мигнула мужу. – J"ai peur, j"ai peur! [Мне страшно, мне страшно!] – прошептала она, содрогаясь спиною.
Муж посмотрел на нее с таким видом, как будто он был удивлен, заметив, что кто то еще, кроме его и Пьера, находился в комнате; и он с холодною учтивостью вопросительно обратился к жене:
– Чего ты боишься, Лиза? Я не могу понять, – сказал он.
– Вот как все мужчины эгоисты; все, все эгоисты! Сам из за своих прихотей, Бог знает зачем, бросает меня, запирает в деревню одну.
– С отцом и сестрой, не забудь, – тихо сказал князь Андрей.
– Всё равно одна, без моих друзей… И хочет, чтобы я не боялась.
Тон ее уже был ворчливый, губка поднялась, придавая лицу не радостное, а зверское, беличье выраженье. Она замолчала, как будто находя неприличным говорить при Пьере про свою беременность, тогда как в этом и состояла сущность дела.
– Всё таки я не понял, de quoi vous avez peur, [Чего ты боишься,] – медлительно проговорил князь Андрей, не спуская глаз с жены.
Княгиня покраснела и отчаянно взмахнула руками.
– Non, Andre, je dis que vous avez tellement, tellement change… [Нет, Андрей, я говорю: ты так, так переменился…]
– Твой доктор велит тебе раньше ложиться, – сказал князь Андрей. – Ты бы шла спать.
Княгиня ничего не сказала, и вдруг короткая с усиками губка задрожала; князь Андрей, встав и пожав плечами, прошел по комнате.
Пьер удивленно и наивно смотрел через очки то на него, то на княгиню и зашевелился, как будто он тоже хотел встать, но опять раздумывал.
– Что мне за дело, что тут мсье Пьер, – вдруг сказала маленькая княгиня, и хорошенькое лицо ее вдруг распустилось в слезливую гримасу. – Я тебе давно хотела сказать, Andre: за что ты ко мне так переменился? Что я тебе сделала? Ты едешь в армию, ты меня не жалеешь. За что?
– Lise! – только сказал князь Андрей; но в этом слове были и просьба, и угроза, и, главное, уверение в том, что она сама раскается в своих словах; но она торопливо продолжала:
– Ты обращаешься со мной, как с больною или с ребенком. Я всё вижу. Разве ты такой был полгода назад?
– Lise, я прошу вас перестать, – сказал князь Андрей еще выразительнее.
Пьер, всё более и более приходивший в волнение во время этого разговора, встал и подошел к княгине. Он, казалось, не мог переносить вида слез и сам готов был заплакать.
– Успокойтесь, княгиня. Вам это так кажется, потому что я вас уверяю, я сам испытал… отчего… потому что… Нет, извините, чужой тут лишний… Нет, успокойтесь… Прощайте…
Князь Андрей остановил его за руку.
– Нет, постой, Пьер. Княгиня так добра, что не захочет лишить меня удовольствия провести с тобою вечер.
– Нет, он только о себе думает, – проговорила княгиня, не удерживая сердитых слез.
– Lise, – сказал сухо князь Андрей, поднимая тон на ту степень, которая показывает, что терпение истощено.
Вдруг сердитое беличье выражение красивого личика княгини заменилось привлекательным и возбуждающим сострадание выражением страха; она исподлобья взглянула своими прекрасными глазками на мужа, и на лице ее показалось то робкое и признающееся выражение, какое бывает у собаки, быстро, но слабо помахивающей опущенным хвостом.
Тема: ТРАНСМЕМБРАННЫЙ ПЕРЕНОС
Внутриклеточные рецепторы: https://www.youtube.com/watch?v=Nm9u4lNCPyM
Метаботропные мембранные рецепторы, связанные с системой вторичных посредников: https://www.youtube.com/watch?v=dQ4yVuLAbH0
Метаботропные мембранные рецепторы, связанные с тирозинкиназной активностью:
Виды трансмембранного переноса.
Типы каналов трансмембранного переноса.
Понятие о полярных и неполярных веществах.
Трансмембранная избирательная проницаемость поддерживает клеточный гомеостаз, оптимальное содержание в клетке ионов, воды, ферментов и субстратов. Пути реализации избирательной проницаемости мембран: пассивный транспорт, катализируемый транспорт (о6легченная диффузия), активный транспорт. Гидрофобный характер сердцевины бислоя определяет возможность (или невозможность) непосредственного проникновения через мембрану различных с физико-химической точки зрения веществ (в первую очередь, полярных и неполярных).
Неполярные вещества (например, холестерин и его производные) свободно проникают через биологические мембраны. По этой причине эндоцитоз и экзоцитоз полярных соединений (например, пептидных гормонов) происходят при помощи мембранных пузырьков, а секреция стероидных гормонов - без участия таких пузырьков. По этой же причине рецепторы неполярных молекул (например, стероидных гормонов) расположены внутри клетки.
Полярные вещества (например, белки и ионы) не могут проникать через биологические мембраны. Именно поэтому рецепторы полярных молекул (например, пептидных гормонов) встроены в плазматическую мембрану, а передачу сигнала к другим клеточным компартментам осуществляют вторые посредники. По этой же причине трансмембранный перенос полярных соединений осуществляют специальные системы, встроенные в биологические мембраны.
Избирательную проницаемость обеспечивает клеточная мембрана; рецепторнуюфункцию реализуют гликопротеиды, углеводные части которых расположены в гликокаликсе;сохранение формы и подвижность обеспечивают фибриллярные и тубулярные белки в подмембранномслое и т.д.
Понятие о рецепторе и лиганде
Клеточный рецептор - молекула на поверхности клетки, ядра, клеточных органелл или растворенная в цитоплазме. Клеточный рецептор специфично реагирует изменением своей пространственной конфигурации (формы) на присоединение к ней молекулы определенного химического вещества – лигáнда , передающего внешний регуляторный сигнал. Это в свою очередь, передает этот сигнал внутрь клетки или клеточной органеллы. Место на рецепторе, куда присоединяется лигáнд, называется сайт. У одного и того же рецептора может быть несколько сайтов. Клеточные рецепторы можно разделить на два основных класса - мембранные рецепторы (расположены на мембране отделяющей клетку от внешней среды) и внутриклеточные рецепторы.
Вещество, специфически соединяющееся с рецептором, называется лигандом (мессенджером) этого рецептора. Т.о., лиганд (синоним: мессенджер) – это химическое вещество, способное взаимодействовать с рецептором. Результат этого взаимодействия может быть различным. Если лиганд (мессенджер) приводит к изменению формы рецептора и его активации его называет агонистом . Если лиганд (мессенджер) изменяют форму (конформацию) рецептора и блокируют этот рецептор его называют антагонистом.
Когда речь идет об органах чувств, лигандами (мессенджерами) являются вещества, воздействующие на рецепторы обоняния или вкуса.
Существуют также термочувствительные белки-рецепторы и белки-рецепторы, реагирующие на изменение мембранного потенциала.
Рецепторы для водорастворимых лигандов (мессенджеров) - белковые гормоны, адреналин, норадреналин - расположены на поверхности мембраны (мембранные рецепторы), это обусловлено тем, что гидрофильные лиганды не могут пройти через гидрофобную поверхность мембраны. Жирорастворимые лиганды (мессенджеры) легко проходят через фосфолипидный бислой мембраны клетки и ядра, а потому рецепторы (внутриклеточные рецепторы) клетка к ним располагает внутри: на органеллах, ядре. Примеры жирорастворимых лигандов могут быть стероидные гормоны надпочечников, половых желез.
Ко всему прочему лиганды можно разделить на экзогенные (поступающие извне) и эндогенные (образуются внутри организма). Как правило, если какое-то экзогенное вещество имеет рецепторы на клетках, то в организме есть и эндогенные лиганды для данного рецептора. Так, например, эндогенными лигандом каннабиноидных рецепторов, с которыми связываются алкалоиды конопли, является вещество анандамид, производимое организмом из арахидоновой жирной кислоты. Или эндорфиновые рецепторы (играют важную роль в формировании боли и эмоционального состояния): могут соединяться с эндогенными лигандами - эндорфины, а могут связываться с наркотиками группы морфина.
Или радикалы, связанные с центр. атомом комплексного соединения. Ими м. б. ионы (Н - , Наl - , NO 3 - , NCS - и др.), неорг. молекулы (Н 2 , С n , N 2 , Р n , О 2 , S n , СО, СО 2 , NH 3 , NO, SO 2 , NO 2 , COS и др.), орг. соед., содержащие элементы главных подгрупп V, VI, VII гр. периодич. системы или p-донорную ф-цию. Большая группа Л.-биологически важные соед. ( , пептиды, пурины, коррины, ) и их синтетич.
аналоги (краун-эфиры, ), а также с донорными атомами и хелатообразующими группировками. Л. могут быть связаны с центр. атомом s-, p- и d-двухцентровыми или многоцентровыми связями. В случае образования двухцентровых связей в Л. можно выделить донорные центры (обычно атомы N, О, S, Cl или ). Многоцентровое связывание осуществляется за счет p-системы ароматич. Л. ( , циклопентадиенид-анион) или гетероароматич. Л. ( , тиофен, метилпиридины). Важнейшая количеств. характеристика донорно-акцепторной способности Л. - дентатность, определяемая числом донорных центров Л., участвующих в координации. По этому признаку Л. делятся на моно-, ди-, ... полидентатные. Координац. число комплексообразователя для монодентатных Л. совпадает с их кол-вом, для прочих равно произведению числа Л. на их дентатность. Природа Л. определяет типы координац. соед. ( , амминокомплексы, мол. аддукты, хелаты, p-комплексы и др.); от нее зависят св-ва, строение и реакц. способность комплексных соед. и возможность их практич. применения. Лит.:
Гарневский А. Д., "Изв. Высш. учеб. заведений, сер. Химия и хим. технология". 1987, т. 30, в. 10, с. 3-16; "Коорд. ", 1988, т. 14, в. 5, с. 579-99; Comprehensive coordination chemistry, v. 2-Ligands, Oxf., 1987. А. Д. Гарновский.
Химическая энциклопедия. - М.: Советская энциклопедия . Под ред. И. Л. Кнунянца . 1988 .
Смотреть что такое "ЛИГАНДЫ" в других словарях:
- (от лат. ligo связываю) в комплексных соединениях молекулы или ионы, связанные с центральным атомом (комплексообразователем), напр. в соединении ЛИГАТУРА (позднелат. ligatura связь) 1) буква или знак фонетической транскрипции, образованный из… … Большой Энциклопедический словарь
лиганды - (адденды) – ионы, радикалы или нейтральные молекулы, которые располагаются вокруг центрального иона (атома) в результате образования координационной связи. Общая химия: учебник / А. В. Жолнин … Химические термины
- (от лат. ligo связываю), в комплексных соединениях молекулы или ионы, связанные с центральным атомом (комплексообразователем), например в соединении Cl3 центральный атом Co, а лиганды молекулы NH3. * * * ЛИГАНДЫ ЛИГАНДЫ (от лат. ligo … Энциклопедический словарь
- (от лат. ligo привязываю) в комплексных соединениях (См. Комплексные соединения) молекулы или ионы, непосредственно связанные с центральным атомом; то же, что Адденды … Большая советская энциклопедия
- (от лат. ligo связываю), в комплексных сосд. молекулы или ионы, связанные с центр, атомом (комплексообразователем), напр. в соед. [Со(NН3)6]С13 центр. атом Со, а Л. молекулы NН3 … Естествознание. Энциклопедический словарь
- … Википедия
Лиганды - (лат. ligo – связываю). Специфические эндогенные вещества, возбуждающие определенные типы клеточных мозговых рецепторов – адренергических, дофаминергических, холинергических, серотонинергических, бензодиазепиновых, пептидергических и др … Толковый словарь психиатрических терминов
лиганды - лиг анды, ов, ед. ч. анд, а … Русский орфографический словарь
Лиганды - (лат. ligo связываю) эндогенные вещества, являющиеся нейромедиаторами в синапсах головного мозга (дофамин, ацетилхолин, серотонин и др.). Психотропные препараты и галлюциногены также обладают некоторыми свойствами лигандов. * * * Биологически… … Энциклопедический словарь по психологии и педагогике
аксиальные лиганды - ašiniai ligandai statusas T sritis chemija apibrėžtis Vienoje ašyje esantys ligandai. atitikmenys: angl. axial ligands rus. аксиальные лиганды ryšiai: sinonimas – aksialiniai ligandai … Chemijos terminų aiškinamasis žodynas
Книги
- Иммунологические проблемы апоптоза , А. Ю. Барышников, Ю. В. Шишкин. Последнее десятилетие ознаменовалось бурным изучением процесса программированной клеточной смерти (апоптоза). Были открыты поверхностные клеточные рецепторы и их лиганды, опосредующие…
Ppt%5C34928-slozhnye_belki_ch1_1.jpg" alt=">Активный центр белка и его взаимодействие с лигандом. В процессе формирования третичной структуры"> Активный центр белка и его взаимодействие с лигандом. В процессе формирования третичной структуры на поверхности функционально активного белка, обычно в углублении, образуется участок, сформированный радикалами аминокислот, далеко стоящими друг от друга в первичной структуре. Этот участок, имеющий уникальное строение для данного белка и способный специфично взаимодействовать с определенной молекулой или группой похожих молекул, называется центром связывания белка с лигандом или активным центром. Лигандами называются молекулы, взаимодействующие с белками.
Ppt%5C34928-slozhnye_belki_ch1_2.jpg" alt=">Лигандом может быть как низкомолекулярное, так и высокомолекулярное (макромолекула) вещество, в том числе и"> Лигандом может быть как низкомолекулярное, так и высокомолекулярное (макромолекула) вещество, в том числе и другой белок. Лигандами являются субстраты ферментов, кофакторы, ингибиторы и активаторы ферментов, протомеры в олигомерном белке и т.д.
Ppt%5C34928-slozhnye_belki_ch1_3.jpg" alt=">Высокая специфичность взаимодействия белка с лигандом обеспечивается комплементарностью структуры активного центра структуре лиганда.">
Ppt%5C34928-slozhnye_belki_ch1_4.jpg" alt=">Комплементарность - это пространственное и химическое соответствие взаимодействующих поверхностей. Активный центр должен не только"> Комплементарность - это пространственное и химическое соответствие взаимодействующих поверхностей. Активный центр должен не только пространственно соответствовать входящему в него лиганду, но и между функциональными группами радикалов, входящих в активный центр, и лигандом должны образоваться связи чаще всего нековалентные (ионные, водородные, а также гидрофобные взаимодействия), которые удерживают лиганд в активном центре.
Ppt%5C34928-slozhnye_belki_ch1_5.jpg" alt=">Комплементарное взаимодействие белка с лигандом">
Ppt%5C34928-slozhnye_belki_ch1_6.jpg" alt=">">
Ppt%5C34928-slozhnye_belki_ch1_7.jpg" alt=">">
Ppt%5C34928-slozhnye_belki_ch1_8.jpg" alt=">КЛАССИФИКАЦИЯ БЕЛКОВ 1. Простые белки состоят только из аминокислот. 2. Сложные белки (холопротеины)"> КЛАССИФИКАЦИЯ БЕЛКОВ 1. Простые белки состоят только из аминокислот. 2. Сложные белки (холопротеины) содержат белковую часть (апопротеин) и небелковую (простетическую) группу.
Ppt%5C34928-slozhnye_belki_ch1_9.jpg" alt=">В качестве простетической группы могут выступать различные органические (липиды, углеводы) и неорганические (металлы) вещества."> В качестве простетической группы могут выступать различные органические (липиды, углеводы) и неорганические (металлы) вещества. Связь между простетической группой и апопротеином может быть как ковалентная, так и нековалентная. Простетическую группу порой можно рассматривать в качестве лиганда. Наличие небелковой части обеспечивает выполнение белком его функции. При утрате простетической группы холопротеин теряет свою активность.
Ppt%5C34928-slozhnye_belki_ch1_10.jpg" alt=">Сложные белки - хромопротеины - нуклеопротеины - липопротеины - фосфопротеины - гликопротеины - металлопротеины">
Ppt%5C34928-slozhnye_belki_ch1_11.jpg" alt=">Металлопротеинам можно отнести холоферменты, содержащие негемовые координационно связанные ионы металлов. Среди металлопротеинов есть белки,"> Металлопротеинам можно отнести холоферменты, содержащие негемовые координационно связанные ионы металлов. Среди металлопротеинов есть белки, выполняющие депонирующие и транспортные функции (например, железосодержащие ферритин и трансферрин) и ферменты (например, цинксодержащая карбоангидраза и различные супероксиддисмутазы, содержащие в качестве активных центров ионы меди, марганца, железа и других металлов). Но и хромопротеины, содержащие ионы металлов, также можно отнести к металлопротеинам.
Ppt%5C34928-slozhnye_belki_ch1_12.jpg" alt=">Металлопротеины часто являются ферментами. Ионы металлов в этом случае: - участвуют в ориентации субстрата"> Металлопротеины часто являются ферментами. Ионы металлов в этом случае: - участвуют в ориентации субстрата в активном центре фермента, входят в состав активного центра фермента и участвуют в катализе, являясь, например, акцепторами электронов на определенной стадии ферментативной реакции. Часто ион металла в составе фермента называют кофактором.
Ppt%5C34928-slozhnye_belki_ch1_13.jpg" alt=">К ферментативным металлопротеинам относятся белки, содержащие например: - медь – цитохромоксидаза, в комплексе"> К ферментативным металлопротеинам относятся белки, содержащие например: - медь – цитохромоксидаза, в комплексе с другими ферментами дыхательной цепи митохондрий участвует в синтезе АТФ, - железо – ферритин, депонирующий железо в клетке, трансферрин, переносящий железо в крови, каталаза, обезвреживающая перекись водорода, - цинк – алкогольдегидрогеназа, обеспечивающая метаболизм этанола и других спиртов, лактатдегидрогеназа, участвующая в метаболизме молочной кислоты, - карбоангидраза, образующая угольную кислоту из CO2 и H2O, - щелочная фосфатаза, гидролизующая фосфорные эфиры различных соединений, - α2-макроглобулин, антипротеазный белок крови. - селен – тиреопероксидаза, участвующая в синтезе гормонов щитовидной железы, антиоксидантный фермент глутатионпероксидаза, - кальций – α-амилаза слюны и панкреатического сока, гидролизующая крахмал.
Ppt%5C34928-slozhnye_belki_ch1_14.jpg" alt=">Ферритин">
Ppt%5C34928-slozhnye_belki_ch1_15.jpg" alt=">Фосфопротеины – это белки, в которых присутствует фосфатная группа. Она связывается с пептидной цепью"> Фосфопротеины – это белки, в которых присутствует фосфатная группа. Она связывается с пептидной цепью через остатки тирозина, серина и треонина, т.е. тех аминокислот, которые содержат ОН-группу. Способ присоединения фосфата к белку на примере серина и тирозина
Ppt%5C34928-slozhnye_belki_ch1_16.jpg" alt=">Фосфорная кислота может выполнять: - Структурную роль, придавая заряд, растворимость и изменяя свойства"> Фосфорная кислота может выполнять: - Структурную роль, придавая заряд, растворимость и изменяя свойства белка, например, в казеине молока, яичном альбумине. Наличие остатков фосфорной кислоты способствует связыванию кальция, что необходимо для формирования, например, костной ткани. - Функциональную роль. В клетке присутствует много белков, которые связаны с фосфатом не постоянно, а в зависимости от активности метаболизма. Белок может многократно переходить в фосфорилированную или в дефосфорилированную форму, что играет регулирующую роль в его работе.
Ppt%5C34928-slozhnye_belki_ch1_17.jpg" alt=">Фосфорилирование - процесс переноса остатка фосфорной кислоты от фосфорилирующего агента-донора к субстрату, как правило,"> Фосфорилирование - процесс переноса остатка фосфорной кислоты от фосфорилирующего агента-донора к субстрату, как правило, катализируемый ферментами (киназами) и ведущий к образованию эфиров фосфорной кислоты. Дефосфорилирование (утрату остатка фосфорной кислоты) катализируют фосфатазы. АТФ + R-OH → АДФ + R-OPO3H2 R-OPO3H2 + Н2О → R-OH + Н3РО4
Ppt%5C34928-slozhnye_belki_ch1_18.jpg" alt=">Примеры: 1) ферменты гликогенсинтаза и гликогенфосфорилаза 2) гистоны в фосфорилированном состоянии менее прочно связываются"> Примеры: 1) ферменты гликогенсинтаза и гликогенфосфорилаза 2) гистоны в фосфорилированном состоянии менее прочно связываются с ДНК и активность генома возрастает. Изменение конформации белка в фосфорилированном и дефосфорилированном состоянии
Ppt%5C34928-slozhnye_belki_ch1_19.jpg" alt=">Липопротеины содержат в качестве простетической части нековалентно связанные липиды. Липиды, в частности"> Липопротеины содержат в качестве простетической части нековалентно связанные липиды. Липиды, в частности жиры, холестерол и его эфиры не растворяются в водных фазах организма, поэтому транспорт их кровью и лимфой осуществляется в виде комплексов с белками и фосфолипидами, которые называются липопротеинами.
Ppt%5C34928-slozhnye_belki_ch1_20.jpg" alt=">Все липопротеины имеют сходное строение: ядро состоит из гидрофобных молекул: триацилглицеролов, эфиров холестерола, а"> Все липопротеины имеют сходное строение: ядро состоит из гидрофобных молекул: триацилглицеролов, эфиров холестерола, а на поверхности находится монослой фосфолипидов, полярные группы которых обращены к воде, а гидрофобные погружены в гидрофобное ядро липопротеина. Кроме фосфолипидов, на поверхности находятся белки – аполипопротеины (апобелками). Их выделяют несколько видов: А, В, С, D. В каждом типе липопротеинов преобладают соответствующие ему апобелки. Аполипопротеины выполняют различные функции. Интегральные аполипопротеины являются структурными компонентами. Периферические аполипопротеины в плазме крови могут передаваться от одного типа липопротеинов к другим, определяя их дальнейшие превращения.
Ppt%5C34928-slozhnye_belki_ch1_21.jpg" alt=">Схема строения липопротеина Строение липопротеина">
Ppt%5C34928-slozhnye_belki_ch1_22.jpg" alt=">Строение липопротеинов плазмы крови">
Ppt%5C34928-slozhnye_belki_ch1_23.jpg" alt=">Выделяют четыре основных класса липопротеинов: -липопротеины высокой плотности (ЛПВП), -липопротеины низкой плотности (ЛПНП),"> Выделяют четыре основных класса липопротеинов: -липопротеины высокой плотности (ЛПВП), -липопротеины низкой плотности (ЛПНП), -липопротеины очень низкой плотности (ЛПОНП), -хиломикроны (ХМ). Каждый из типов ЛП образуется в разных тканях и транспортирует определённые липиды. Концентрация и соотношение в крови тех или иных липопротеинов играют ведущую роль в возникновении такой распространенной сосудистой патологии как атеросклероз. ЛПВП являются антиатерогенными, ЛПНП и ЛПОНП – атерогенными.
Ppt%5C34928-slozhnye_belki_ch1_24.jpg" alt=">">
Ppt%5C34928-slozhnye_belki_ch1_25.jpg" alt=">Гликопротеины или, гликоконъюгаты – это белки, содержащие углеводный компонент, ковалентно присоединенный к полипептидной основе."> Гликопротеины или, гликоконъюгаты – это белки, содержащие углеводный компонент, ковалентно присоединенный к полипептидной основе. Содержание углеводов в них варьирует от 1% до 98% по массе. Два подкласса белков, содержащих углеводы: ■ протеогликаны ■ гликопротеины
Description="">
Ppt%5C34928-slozhnye_belki_ch1_27.jpg" alt=">Для гликопротеинов характерно невысокое содержание углеводов, которые присоединены: - N-гликозидной связью к NН2-группе какого-нибудь"> Для гликопротеинов характерно невысокое содержание углеводов, которые присоединены: - N-гликозидной связью к NН2-группе какого-нибудь аминокислотного остатка, например, аспарагина; - О-гликозидной связью к гидроксильной группе остатка серина, треонина,тирозина, гидроксилизина.
Ppt%5C34928-slozhnye_belki_ch1_28.jpg" alt=">Образование О- и N-гликозидных связей в гликопротеинах. 1 - N-гликозидная связь между амидной группой"> Образование О- и N-гликозидных связей в гликопротеинах. 1 - N-гликозидная связь между амидной группой аспарагина и ОН-группой моносахарида; 2 - О-гликозидная связь между ОН-группой серина и ОН-группой моносахарида.
Ppt%5C34928-slozhnye_belki_ch1_29.jpg" alt=">Способ присоединения углевода к белку">
Ppt%5C34928-slozhnye_belki_ch1_30.jpg" alt=">Функцией гликопротеинов являются: 1. Структурная – клеточная стенка бактерий, костный матрикс, например, коллаген, эластин."> Функцией гликопротеинов являются: 1. Структурная – клеточная стенка бактерий, костный матрикс, например, коллаген, эластин. 2. Защитная – например, антитела, интерферон, факторы свертывания крови (протромбин, фибриноген). 3. Рецепторная – присоединение эффектора приводит к изменению конформации белка-рецептора, что вызывает внутриклеточный ответ. 4. Гормональная – гонадотропный, адренокортикотропный и тиреотропный гормоны. 5. Ферментативная – холинэстераза, нуклеаза. 6. Транспортная – перенос веществ в крови и через мембраны, например, трансферрин, транскортин, альбумин, Na+,К+-АТФаза.
Ppt%5C34928-slozhnye_belki_ch1_31.jpg" alt=">Схема строения белка-рецептора">
Ppt%5C34928-slozhnye_belki_ch1_32.jpg" alt=">Хромопротеины - собирательное название сложных белков с окрашенными простетическими группами различной химической природы. "> Хромопротеины - собирательное название сложных белков с окрашенными простетическими группами различной химической природы. гемопротеины (содержат гем), ретинальпротеины (содержат витамин А), флавопротеины (содержат витамин В2), кобамидпротеины (содержат витамин В12).
Ppt%5C34928-slozhnye_belki_ch1_33.jpg" alt=">Флавопротеины - это ферменты окислительно-восстановительных реакций. Содержат производные витамина В2 флавинмононуклеотид (ФМН) и флавинадениндинуклеотид"> Флавопротеины - это ферменты окислительно-восстановительных реакций. Содержат производные витамина В2 флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД). Связываются данные простетические группы ковалентно и придают желтое окрашивание. Эти простетические группы являются производными изоаллоксазина.
Ppt%5C34928-slozhnye_belki_ch1_34.jpg" alt=">Изоаллоксазин - гетероциклическое соединения, производное птеридина. Молекула изоаллоксазина состоит из трех ароматических колец -"> Изоаллоксазин - гетероциклическое соединения, производное птеридина. Молекула изоаллоксазина состоит из трех ароматических колец - бензольного, пиримидинового, пиразинового.
Ppt%5C34928-slozhnye_belki_ch1_35.jpg" alt=">Гемопротеины - гем-содержащие хромопротеины. В качестве небелкового компонента включают структурно сходные железо- или магнийпорфирины."> Гемопротеины - гем-содержащие хромопротеины. В качестве небелкового компонента включают структурно сходные железо- или магнийпорфирины. Белковый компонент может быть разнообразным как по составу, так и по структуре. Основу структуры простетической группы большинства гемосодержащих белков составляет порфириновое кольцо, являющееся в свою очередь производным тетрапиррольного соединения – порфирина. Порфирин
Ppt%5C34928-slozhnye_belki_ch1_36.jpg" alt=">Порфириновое кольцо способно образовывать координационные соединения с различными ионами металлов. В результате комплексообразования формируются"> Порфириновое кольцо способно образовывать координационные соединения с различными ионами металлов. В результате комплексообразования формируются металлопорфирины: содержащие ионы железа – гемоглобины, миоглобин, цитохромы, пероксидаза, каталаза и др. (красное окрашивание), содержщие ионы магния – хлорофилл (зеленое окрашивание). Витамин В12 (кобалимин) содержит координированный ион кобальта Со2+ в порфириноподобном макроцикле – коррине, состоящем из четырех частично гидрированных пиррольных колец (розовое окрашивание).
Ppt%5C34928-slozhnye_belki_ch1_37.jpg" alt=">Хлорофилл b. Хлорофиллы участвуют в процессах фотосинтеза.">
Ppt%5C34928-slozhnye_belki_ch1_38.jpg" alt=">Цитохромы различаются аминокислотным составом пептидных цепей, числом цепей и разделяются на типы а, b,"> Цитохромы различаются аминокислотным составом пептидных цепей, числом цепей и разделяются на типы а, b, с, d. Цитохромы находятся в составе дыхательной цепи и цепи микросомального окисления. Степень окисления железа в составе цитохромов меняется в отличие от гемоглобина и миоглобина Fe2+ ↔ Fe3+
Ppt%5C34928-slozhnye_belki_ch1_39.jpg" alt=">Миоглобин (Мв) - белок, находящийся в красных мышцах, основная функция которого - создание запасов"> Миоглобин (Мв) - белок, находящийся в красных мышцах, основная функция которого - создание запасов О2, необходимых при интенсивной мышечной работе. Мв - сложный белок, содержащий белковую часть - апоМв и небелковую часть - гем. Первичная структура апоМв определяет его компактную глобулярную конформацию и структуру активного центра, к которому присоединяется небелковая часть миоглобина - гем. Кислород, поступающий из крови в мышцы, связывается с Fe2+ гема в составе миоглобина. Мв - мономерный белок, имеющий очень высокое сродство к О2, поэтому отдача кислорода миоглобином происходит только при интенсивной мышечной работе, когда парциальное давление O2 резко снижается. Формирование пространственных структур и функционирование миоглобина.
Ppt%5C34928-slozhnye_belki_ch1_40.jpg" alt=">Формирование конформации Мв. В красных мышцах на рибосомах в ходе трансляции идет синтез первичной"> Формирование конформации Мв. В красных мышцах на рибосомах в ходе трансляции идет синтез первичной структуры Мв, представленной специфической последовательностью 153 аминокислотных остатков. Вторичная структура Мв содержит восемь α-спиралей, называемых латинскими буквами от А до Н, между которыми имеются неспирализованные участки. Третичная структура Мв имеет вид компактной глобулы, в углублении которой между F и Е α-спиралями расположен активный центр.
Ppt%5C34928-slozhnye_belki_ch1_41.jpg" alt=">Структура миоглобина">
Ppt%5C34928-slozhnye_belki_ch1_42.jpg" alt=">Особенности строения и функционирования активного центра Мв. Активный центр Мв сформирован преимущественно гидрофобными радикалами"> Особенности строения и функционирования активного центра Мв. Активный центр Мв сформирован преимущественно гидрофобными радикалами аминокислот, далеко отстоящими друг от друга в первичной структуре (например, Три39 и Фен138). К активному центру присоединяется плохо растворимые в воде лиганды - гем и О2. Гем - специфический лиганд апоМв.
Ppt%5C34928-slozhnye_belki_ch1_43.jpg" alt=">Основу гема составляют четыре пиррольных кольца, соединенных метенильными мостиками; в центре расположен атом Fe2+,"> Основу гема составляют четыре пиррольных кольца, соединенных метенильными мостиками; в центре расположен атом Fe2+, соединенный с атомами азота пиррольных колец четырьмя координационными связями. В активном центре Мв кроме гидрофобных радикалов аминокислот имеются также остатки двух аминокислот с гидрофильными радикалами - Гис Е7 (Гис64) и Гис F8 (Гис93).
Ppt%5C34928-slozhnye_belki_ch1_44.jpg" alt=">Гис F8 образует координационную связь с Fe2+ и прочно фиксирует гем в активном центре."> Гис F8 образует координационную связь с Fe2+ и прочно фиксирует гем в активном центре. Гис Е7 необходим для правильной ориентации в активном центре другого лиганда - O2 при его взаимодействии с Fe+2 гема. Микроокружение гема создает условия для прочного, но обратимого связывания O2 с Fe+2 и препятствует попаданию в гидрофобный активный центр воды, что может привести к его окислению в Fе3+.
Ppt%5C34928-slozhnye_belki_ch1_45.jpg" alt=">Олигомерное строение Нв и регуляция сродства Нв к О2 лигандами. Гемоглобины человека -"> Олигомерное строение Нв и регуляция сродства Нв к О2 лигандами. Гемоглобины человека - семейство белков, так же как и миоглобин относящиеся к сложным белкам (гемопротеинам). Они имеют тетрамерное строение и содержат две α-цепи, но различаются по строению двух других полипептидных цепей (2α-, 2х-цепи). Строение второй полипептидной цепи определяет особенности функционирования этих форм Нв. Около 98% гемоглобина эритроцитов взрослого человека составляет гемоглобин А (2α-, 2β-цепи). В период внутриутробного развития функционируют два основных типа гемоглобинов: эмбриональный Нв (2α, 2ε), который обнаруживается на ранних этапах развития плода, и гемоглобин F (фетальный) - (2α, 2γ), который приходит на смену раннему гемоглобину плода на шестом месяце внутриутробного развития и только после рождения замещается на Нв А.
Ppt%5C34928-slozhnye_belki_ch1_46.jpg" alt=">Нв А - белок, родственный миоглобину (Мв), содержится в эритроцитах взрослого человека. Строение его"> Нв А - белок, родственный миоглобину (Мв), содержится в эритроцитах взрослого человека. Строение его отдельных протомеров аналогично таковому у миоглобина. Вторичная и третичная структуры миоглобина и протомеров гемоглобина очень сходны, несмотря на то что в первичной структуре их полипептидных цепей идентичны только 24 аминокислотных остатка (вторичная структура протомеров гемоглобина, так же как миоглобин, содержит восемь α-спиралей, обозначаемых латинскими буквами от А до Н, а третичная структура имеет вид компактной глобулы). Но в отличие от миоглобина гемоглобин имеет олигомерное строение, состоит из четырех полипептидных цепей, соединенных нековалентными связями.
Ppt%5C34928-slozhnye_belki_ch1_47.jpg" alt=">Олигомерная структура гемоглобина">
Ppt%5C34928-slozhnye_belki_ch1_48.jpg" alt=">Каждый протомер Нв связан с небелковой частью - гемом и соседними протомерами. Соединение белковой"> Каждый протомер Нв связан с небелковой частью - гемом и соседними протомерами. Соединение белковой части Нв с гемом аналогично таковому у миоглобина: в активном центре белка гидрофобные части гема окружены гидрофобными радикалами аминокислот за исключением Гис F8 и Гис Е7, которые расположены по обе стороны от плоскости гема и играют аналогичную роль в функционировании белка и связывании его с кислородом. Кроме того, Гис Е7 выполняет важную дополнительную роль в функционировании Нв. Свободный гем имеет в 25 000 раз более высокое сродство к СО, чем к О2. СО в небольших количествах образуется в организме и, учитывая его высокое сродство к гему, он мог бы нарушать транспорт необходимого для жизни клеток О2. Однако в составе гемоглобина сродство гема к оксиду углерода превышает сродство к О2 всего в 200 раз благодаря наличию в активном центре Гис Е7. Остаток этой аминокислоты создает оптимальные условия для связывания гема с O2 и ослабляет взаимодействие гема с СО.
Ppt%5C34928-slozhnye_belki_ch1_49.jpg" alt=">">
Ppt%5C34928-slozhnye_belki_ch1_50.jpg" alt=">Пиррольные кольца гема расположены в одной плоскости, а ион Fe2+ в неоксигенированом состоянии Hb"> Пиррольные кольца гема расположены в одной плоскости, а ион Fe2+ в неоксигенированом состоянии Hb выступает над плоскостью на 0,6 А. При присоединении кислорода ион железа погружается в плоскость колец гема. В результате сдвигается и участок полипептидной цепи, нарушаются слабые связи в молекуле Hb и изменяется конформация всей глобулы. Таким образом, присоединение кислорода вызывает изменение пространственной структуры молекулы миоглобина или протомеров гемоглобина.
Ppt%5C34928-slozhnye_belki_ch1_51.jpg" alt=">Гемоглобин может существовать как в свободной (дезоксигемоглобин), так и в оксигенированной форме, присоединяя до"> Гемоглобин может существовать как в свободной (дезоксигемоглобин), так и в оксигенированной форме, присоединяя до 4 молекул кислорода. Взаимодействие с кислородом 1-го протомера вызывает изменение его конформации, а также кооперативные конформационные изменения остальных протомеров. Сродство к кислороду возрастает, и присоединение О2 к активному центру 2-го протомера происходит легче, вызывая дальнейшую конформационную перестройку всей молекулы. В результате еще сильнее изменяется структура оставшихся протомеров и их активных центров, взаимодействие с О2 еще больше облегчается. В итоге 4-я молекула кислорода присоединяется к Hb примерно в 300 раз легче, чем 1-я. Так происходит в легких при высоком парциальном давлении кислорода.
Ppt%5C34928-slozhnye_belki_ch1_52.jpg" alt=">Кооперативные изменения конформации молекулы гемоглобина при взаимодействии с кислородом">
Ppt%5C34928-slozhnye_belki_ch1_53.jpg" alt=">В тканях, где содержание кислорода ниже, наоборот, отщепление каждой молекулы О2 облегчает освобождение последующих."> В тканях, где содержание кислорода ниже, наоборот, отщепление каждой молекулы О2 облегчает освобождение последующих. Таким образом, взаимодействие олигомерного белка гемоглобина с лигандом (О2) в одном центре связывания приводит к изменению конформации всей молекулы и других, пространственно удаленных центров, расположенных на других субъединицах (принцип «домино»). Подобные взаимосвязанные изменения структуры белка называют кооперативными конформационными изменениями. Они характерны для всех олигомерных белков и используются для регуляции их активности.
Ppt%5C34928-slozhnye_belki_ch1_54.jpg" alt=">Взаимодействие обоих белков (Mb и Hb) с кислородом зависит от его парциального давления в"> Взаимодействие обоих белков (Mb и Hb) с кислородом зависит от его парциального давления в тканях. Эта зависимость имеет разный характер, что связано с их особенностями структуры и функционирования. Гемоглобин имеет S-образную кривую насыщения, которая показывает, что субъединицы белка работают кооперативно, и чем больше кислорода они отдают, тем легче идет освобождение остальных молекул О2. Этот процесс зависит от изменения парциального давления кислорода в тканях. График насыщения миоглобина кислородом имеет характер простой гиперболы, т.е. насыщение Mb кислородом происходит быстро и отражает его функцию - обратимое связывание с кислородом, высвобождаемым гемоглобином, и освобождение в случае интенсивной физической нагрузки.
Ppt%5C34928-slozhnye_belki_ch1_55.jpg" alt=">Кривые насыщения миоглобина и гемоглобина кислородом">
Ppt%5C34928-slozhnye_belki_ch1_56.jpg" alt=">CO2 и Н+, образующиеся при катаболизме органических веществ, уменьшают сродство гемоглобина к О2 пропорционально"> CO2 и Н+, образующиеся при катаболизме органических веществ, уменьшают сродство гемоглобина к О2 пропорционально их концентрации. Энергия, необходимая для работы клеток, вырабатывается преимущественно в митохондриях при окислении органических веществ с использованием O2, доставляемого из легких гемоглобином. В результате окисления органических веществ образуются конечные продукты их распада: СО2 и Н2O, количество которых пропорционально интенсивности протекающих процессов окисления. СO2 диффузией попадает из клеток в кровь и проникает в эритроциты, где под действием фермента карбоангидразы превращается в угольную кислоту. Эта слабая кислота диссоциирует на протон и бикарбонат ион. СО2 + Н2О → Н2СО3 → Н+ + НСО3-
Ppt%5C34928-slozhnye_belki_ch1_57.jpg" alt=">Ионы Н+ способны присоединятся к радикалам Гис146 в β-цепях гемоглобина, т.е. в участках, удаленных"> Ионы Н+ способны присоединятся к радикалам Гис146 в β-цепях гемоглобина, т.е. в участках, удаленных от гема. Протонирование гемоглобина снижает его сродство к О2, способствует отщеплению О2 от оксиНв, образованию дезоксиНв и увеличивает поступление кислорода в ткани пропорционально количеству образовавшихся протонов. Увеличение количества освобожденного кислорода в зависимости от увеличения концентрации Н+ в эритроцитах называется эффектом Бора (по имени датского физиолога Христиана Бора, впервые открывшего этот эффект). В легких высокое парциальное давление кислорода способствует его связыванию с дезоксиНв, что уменьшает сродство белка к Н+. Освободившиеся протоны под действием карбоангидразы взаимодействуют с бикарбонатами с образованием СО2 и Н2О
Ppt%5C34928-slozhnye_belki_ch1_58.jpg" alt=">Зависимость сродства Нв к О2 от концентрации СО2 и протонов (эффект Бора): А -"> Зависимость сродства Нв к О2 от концентрации СО2 и протонов (эффект Бора): А - влияние концентрации СО2 и Н+ на высвобождение О2 из комплекса с Нв (эффект Бора); Б - оксигенирование дезоксигемоглобина в легких, образование и выделение СО2.
Ppt%5C34928-slozhnye_belki_ch1_59.jpg" alt=">Образовавшийся СО2 поступает в альвеолярное пространство и удаляется с выдыхаемым воздухом. Таким образом, количество"> Образовавшийся СО2 поступает в альвеолярное пространство и удаляется с выдыхаемым воздухом. Таким образом, количество высвобождаемого гемоглобином кислорода в тканях регулируется продуктами катаболизма органических веществ: чем интенсивнее распад веществ, например при физических нагрузках, тем выше концентрация СО2 и Н+ и тем больше кислорода получают ткани в результате уменьшения сродства Нв к О2.
Ppt%5C34928-slozhnye_belki_ch1_60.jpg" alt=">Изменение функциональной активности белка при взаимодействии с другими лигандами вследствие конформационных изменений называется аллостерической"> Изменение функциональной активности белка при взаимодействии с другими лигандами вследствие конформационных изменений называется аллостерической регуляцией, а соединения-регуляторы - аллостерическими лигандами или эффекторами. Способность к аллостерической регуляции характерна, как правило, для олигомерных белков, т.е. для проявления аллостерического эффекта необходимо взаимодействие протомеров. При воздействии аллостерических лигандов белки меняют свою конформацию (в том числе и активного центра) и функцию.
Ppt%5C34928-slozhnye_belki_ch1_61.jpg" alt=">Аллостерическая регуляция сродства Нв к О2 лигандом - 2,3-бис-фосфоглицератом. В эритроцитах из продукта"> Аллостерическая регуляция сродства Нв к О2 лигандом - 2,3-бис-фосфоглицератом. В эритроцитах из продукта окисления глюкозы - 1,3-бисфосфоглицерата синтезируется аллостерический лиганд гемоглобина - 2,3-бисфосфоглицерат (2,3-БФГ). В нормальных условиях концентрация 2,3-БФГ высокая и сравнима с концентрацией Нв. 2,3-БФГ имеет сильный отрицательный заряд (-5).
Ppt%5C34928-slozhnye_belki_ch1_62.jpg" alt=">В центре тетрамерной молекулы гемоглобина находится полость. Ее образуют аминокислотные остатки всех четырех протомеров."> В центре тетрамерной молекулы гемоглобина находится полость. Ее образуют аминокислотные остатки всех четырех протомеров. В капиллярах тканей протонирование Нв (эффект Бора) приводит к разрыву связи между железом гема и О2. В молекуле дезоксигемоглобина по сравнению с оксигемоглобином возникают дополнительные ионные связи, соединяющие протомеры, вследствие чего размеры центральной полости по сравнению с оксигемоглобином увеличиваются. Центральная полость является местом присоединения 2,3-БФГ к гемоглобину. БФГ поступает в полость дезоксигемоглобина. 2,3-БФГ взаимодействует с гемоглобином в участке, удаленном от активных центров белка и относится к аллостерическим (регуляторным) лигандам, а центральная полость Нв является аллостерическим центром. 2,3-БФГ имеет сильный отрицательный заряд и взаимодействует с положительно заряженными группами двух β-цепей Нв. При этом его сродство к О2 снижается в 26 раз. В результате происходит высвобождение кислорода в капиллярах ткани при низком парциальном давлении О2. В легких высокое парциальное давление О2, наоборот, приводит к оксигенированию Нв и освобождению БФГ.
Ppt%5C34928-slozhnye_belki_ch1_63.jpg" alt=">Центр связывания БФГ находится в положительно заряженной полости между 4 протомерами гемоглобина. Взаимодействие БФГ"> Центр связывания БФГ находится в положительно заряженной полости между 4 протомерами гемоглобина. Взаимодействие БФГ с центром связывания изменяет конформацию α- и β-протомеров НЬ и их активных центров. Сродство НЬ к молекулам О2 снижается и кислород высвобождается в ткани. В легких при высоком парциальном давлении О2 активные центры гемоглобина насыщаются за счет изменения конформации и БФГ вытесняется из аллостерического центра
Ppt%5C34928-slozhnye_belki_ch1_64.jpg" alt=">">
Ppt%5C34928-slozhnye_belki_ch1_65.jpg" alt=">Таким образом, олигомерные белки обладают новыми по сравнению с мономерными белками свойствами. Присоединение лигандов"> Таким образом, олигомерные белки обладают новыми по сравнению с мономерными белками свойствами. Присоединение лигандов на участках, пространственно удаленных друг от друга (аллостерических), способно вызывать конформационные изменения во всей белковой молекуле. Благодаря взаимодействию с регуляторными лигандами происходит изменение конформации и адаптация функции белковой молекулы к изменениям окружающей среды.
Ppt%5C34928-slozhnye_belki_ch1_66.jpg" alt=">Около 15% углекислого газа, присутствующего в крови, переносится молекулами гемоглобина. В тканях часть молекул"> Около 15% углекислого газа, присутствующего в крови, переносится молекулами гемоглобина. В тканях часть молекул углекислого газа может присоединится к каждому протомеру молекулы гемоглобина, при этом снижается сродство Hb к кислороду. В легких, наоборот, из-за высокого парциального давления кислорода, О2 связывается с Hb, а СО2 высвобождается.
Ppt%5C34928-slozhnye_belki_ch1_67.jpg" alt=">">
Ppt%5C34928-slozhnye_belki_ch1_68.jpg" alt=">В молекуле гемоглобина S (так назван аномальный гемоглобин) мутантными оказались 2 β-цепи, в которых"> В молекуле гемоглобина S (так назван аномальный гемоглобин) мутантными оказались 2 β-цепи, в которых глутамат, высокополярная отрицательно заряженная аминокислота в положении 6 была заменена валином, содержащим гидрофобный радикал.





